Щелочные металлы - это группа элементов периодической таблицы, которые встречаются в первой группе семьи щелочных металлов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы имеют сходные химические свойства, что объясняется их общей электронной конфигурацией и одним электроном в внешней энергетической оболочке.
Щелочные металлы обладают низкой плотностью и низкой температурой плавления и кипения. Они хорошо растворяются в воде и образуют щелочные растворы. Также они реагируют с кислородом, азотом и серой, образуя оксиды, нитриды и сульфиды соответственно. Кроме того, щелочные металлы легко окисляются и образуют положительные ионы.
Щелочные металлы имеют широкое применение в различных областях. Например, литий используется в производстве аккумуляторов, а также в лекарственной и стекольной промышленности. Натрий используется в пищевой промышленности, в производстве стекла и мыла, а также в качестве средства для сохранения сыра и мяса. Калий широко применяется в сельском хозяйстве, в производстве удобрений и органических соединений. Другие щелочные металлы также имеют множество применений в различных отраслях науки и промышленности.
Итак, щелочные металлы представляют собой группу элементов схожих химических свойств. Они обладают низкой плотностью и температурой плавления, легко растворяются в воде и образуют щелочные растворы. Щелочные металлы имеют широкое применение в различных отраслях и играют важную роль в нашей повседневной жизни.
Определение и свойства щелочных металлов

Щелочные металлы - это элементы химического периодического стола, которые находятся в первой группе. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы относятся к металлам, их атомы имеют низкую энергию ионизации и обладают высокой активностью химической реакции.
Свойства щелочных металлов:
- Мягкость и пластичность: щелочные металлы являются мягкими и легкими, они могут быть нарезаны ножом или раскатаны в тонкие слои. Это связано с низкой прочностью связи между атомами металлов и слабостью межметаллических связей.
- Реактивность с водой: щелочные металлы реагируют с водой, образуя щелочи и выделяя водород. Эта реакция обусловлена высокой потенциальной энергией атомов щелочных металлов и их способностью отдавать электроны.
- Окрашенность пламени: многие щелочные металлы при нагревании образуют окраску пламени. Например, калий дает фиолетовое, натрий - желтоватое и рубидий - красноватое пламя.
- Термическая и электрическая проводимость: щелочные металлы обладают высокой термической и электрической проводимостью. Это связано с наличием свободных электронов в их структуре, которые легко перемещаются по металлической решетке.
- Образование ионов: щелочные металлы образуют положительно заряженные ионы, выделяющиеся в растворах. Это обусловлено их высокой электроотрицательностью и способностью отдавать электроны другим атомам.
Щелочные металлы широко используются в различных областях, включая производство стекла и мыла, получение металлов и сплавов, а также в химической промышленности. Их свойства делают их ценными элементами с распространенными применениями в нашей повседневной жизни.
Способы получения щелочных металлов

Щелочные металлы – это элементы химической группы с одним электроном во внешней электронной оболочке. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Важно отметить, что щелочные металлы являются высокореактивными и очень тяжелыми элементами.
Получение щелочных металлов осуществляется несколькими способами.
Электролиз солей. Один из наиболее распространенных способов получения щелочных металлов заключается в проведении электролиза солей этих металлов. При этом положительно заряженная электродная поверхность привлекает отрицательно заряженные ионы, что позволяет выделить щелочные металлы в виде чистых металлических образцов.
Восстановление оксидов. Другим способом получения щелочных металлов является восстановление оксидов с помощью сильных восстановителей, например, металлов группы алюминия или магния. Оксиды щелочных металлов при такой реакции превращаются в металлические формы.
Сплавление с другими металлами. Щелочные металлы также можно получить путем сплавления с другими металлами, например, с главной подгруппой бора или алюминия. При этом металлические соединения разлагаются, и металлы щелочных элементов извлекаются из получившейся смеси.
Все эти способы получения щелочных металлов требуют строгого контроля и специальных условий, так как эти элементы являются очень реактивными и требуют особых мер предосторожности при работе с ними.
Применение щелочных металлов в промышленности и науке
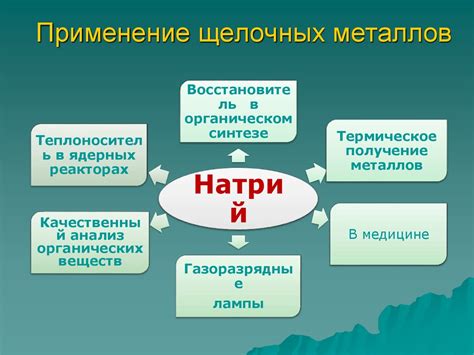
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое применение в промышленности и науке благодаря своим уникальным свойствам.
Литий широко используется в производстве легких, прочных и долговечных аккумуляторов. Его применение также находит в производстве графитовых электродов и алюминия. Литий является неотъемлемым компонентом в различных фармацевтических препаратах и железнодорожной промышленности.
Натрий широко используется в производстве стекла и жидкостных ракетных топлив. Он также находит применение в производстве моющих средств и пищевой промышленности. Натрий используется как реагент в химических процессах и является необходимым компонентом в производстве бумаги и текстиля.
Калий является важным элементом для растений. Он используется в производстве минеральных удобрений, способствующих улучшению качества почвы и повышению урожайности. Калий также находит применение в производстве стекла, мыла и многих других химических продуктов. Благодаря своим химическим свойствам, калий используется в лабораториях для проведения различных химических экспериментов.
Рубидий и цезий находят применение в научных исследованиях и технологических процессах. Они используются в качестве источников ионизирующего излучения в медицине и в производстве электрических компонентов, таких как фотовольтаические элементы и электронные устройства. Рубидий и цезий также используются в оптических часах и гравиметрии.
В целом, щелочные металлы играют важную роль в различных отраслях промышленности и науки благодаря своим химическим и физическим свойствам. Их уникальные характеристики делают их незаменимыми компонентами в производстве различных продуктов и материалов.
Щелочные металлы в живых организмах

Щелочные металлы, такие как литий, натрий, калий и другие, являются необходимыми элементами для многих живых организмов. Они выполняют важные функции в организмах, обеспечивая поддержание нормального баланса электролитов и регулируя активность различных клеточных процессов.
Литий, например, играет роль в регуляции настроения и может использоваться в лечении некоторых психических расстройств, таких как биполярное расстройство. Натрий и калий играют важную роль в нервной системе, обеспечивая передачу нервных импульсов и контролируя сокращение мышц. Они также влияют на уровень влаги в организме и поддерживают гомеостаз внутренней среды.
Однако, несмотря на важность щелочных металлов для здоровья, их потребление должно быть в достаточном, но умеренном количестве. Избыток щелочных металлов в организме может привести к различным патологиям, таким как гипернатриемия или гиперкалиемия. Поэтому важно следить за балансом потребления щелочных металлов и их выведения из организма через почки и пот.
В природе щелочные металлы широко распространены и присутствуют в различных растениях и животных. Некоторые растительные продукты, такие как бананы и орехи, являются хорошим источником калия, а морские продукты могут содержать значительное количество натрия. Также, особенно в жаркую погоду, организмы могут испытывать дефицит щелочных металлов, который необходимо компенсировать через правильное питание или прием специализированных препаратов.
Опасность использования щелочных металлов

Щелочные металлы, такие как литий, натрий и калий, обладают не только полезными свойствами, но и опасными характеристиками. Их использование требует особой осторожности и соблюдения предписанных мер безопасности.
Одним из основных рисков при работе с щелочными металлами является их высокая реактивность. Они легко вступают во взаимодействие с кислородом из воздуха или водой, что может привести к возникновению пожара или взрыва. Поэтому необходимо хранить и транспортировать щелочные металлы в специальных контейнерах, а при работе использовать защитные очки и рукавицы.
Другой опасностью является их высокая реакционная способность с водой. Процесс взаимодействия щелочных металлов с водой сопровождается выделением водорода, который является горючим газом. Взрывоопасность таких ситуаций может возрасти, если щелочные металлы находятся в больших количествах или смешиваются с другими реагентами.
Кроме того, щелочные металлы могут вызывать серьезные ожоги при контакте с кожей или глазами. Они быстро проникают в ткани и вызывают глубокие химические ожоги, которые могут привести к длительному периоду восстановления. Поэтому при работе с щелочными металлами необходимо использовать защитное оборудование и немедленно промыть поврежденные участки кожи водой.
В целом, использование щелочных металлов может быть опасным, если не соблюдаются соответствующие меры предосторожности. Важно знать и понимать свойства этих веществ, а также обучать персонал, который будет ими работать, чтобы минимизировать риски и обеспечить безопасность процессов, связанных с использованием щелочных металлов.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие свойства характерны для щелочных металлов?
Щелочные металлы обладают следующими свойствами: они являются мягкими и легкими металлами, легко реагируют с водой, образуя щелочные растворы, обладают низкой плотностью, имеют низкую температуру плавления и кипения, являются хорошими проводниками тепла и электричества.
