Щелочные металлы представляют собой группу химических элементов, которые расположены в первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются рядом уникальных химических свойств, которые делают их важными в различных промышленных и химических процессах.
Первое химическое свойство щелочных металлов - их активность. Щелочные металлы имеют высокую реакционную способность, что означает, что они легко взаимодействуют с другими элементами или соединениями. Они реагируют с кислородом воздуха, создавая оксиды, и с водой, образуя гидроксиды и высвобождая водородный газ. Это активное поведение делает щелочные металлы ценными для использования в различных химических процессах.
Второе химическое свойство щелочных металлов - их способность образовывать ионы с положительным зарядом. Щелочные металлы имеют одну валентную электронную оболочку, которая легко отдается, образуя ионы M+, где M представляет собой элемент щелочного металла. Эти положительные ионы хорошо растворяются в воде и образуют сильные щелочные растворы. Ионы щелочных металлов также обладают высокой подвижностью и широко используются в электрохимических процессах.
Третье химическое свойство щелочных металлов - их способность образовывать соединения с другими элементами. Щелочные металлы формируют множество солей, таких как хлориды и сульфаты, которые широко используются в различных промышленных и химических процессах. Эти соединения имеют разные свойства и могут использоваться для получения различных продуктов, в том числе удобрений, стекла, мыла и многих других.
Обзор химических свойств щелочных металлов
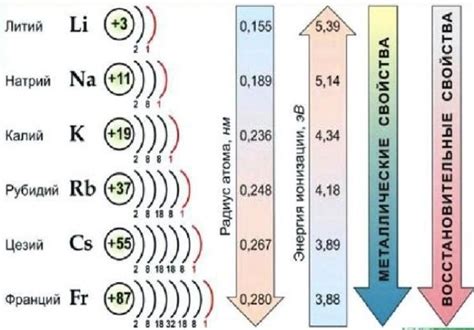
Щелочные металлы - это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Свойства щелочных металлов обусловлены их электронной конфигурацией и химической активностью.
Первое общее свойство щелочных металлов - это их реактивность с водой. Когда щелочный металл вступает в контакт с водой, образуется щелочное гидроксидное растворение и выделяется водород газ. Это явление объясняется тем, что щелочные металлы имеют низкую ионизационную энергию и готовы отдать свой внешний электрон, чтобы образовать ион щелочного металла и гидроксида.
Еще одной характеристикой щелочных металлов является их способность к окислению. Они имеют единственное внешнее электронное валентное кольцо и готовы отдать его для образования положительных ионов. Поэтому щелочные металлы обладают сильным восстановительным действием и могут реагировать с различными веществами в химических реакциях окисления-восстановления.
Щелочные металлы имеют низкую плотность и низкую температуру плавления, что делает их хорошими материалами для использования в различных приложениях, таких как легкие конструкции и пиротехнические смеси. Они также обладают высокой электропроводностью и хорошей теплопроводностью, что делает их полезными в электронике и энергетике.
В заключение, щелочные металлы обладают рядом химических характеристик, которые делают их особенно активными и полезными в различных областях науки и промышленности.
Свойства щелочных металлов в химических реакциях

Щелочные металлы образуют множество химических соединений и проявляют интересные свойства в химических реакциях.
Одно из основных свойств щелочных металлов - высокая активность. Они легко реагируют с водой, выделяя водород и образуя оксиды-основания. Например, реакция натрия с водой протекает следующим образом:
- Na + H2O → NaOH + H2
В результате такой реакции образуется гидроксид натрия (NaOH), который является основанием и обладает щелочными свойствами.
Щелочные металлы также реагируют с кислородом, образуя оксиды. Например, реакция действия кислорода на литий:
- 4Li + O2 → 2Li2O
Полученный оксид лития (Li2O) обладает щелочными свойствами и растворяется в воде, образуя гидроксид лития (LiOH).
Свойства щелочных металлов еще проявляются при взаимодействии с другими веществами. Например, щелочные металлы реагируют с кислотами, образуя соли и выделяя воду:
- 2Na + 2HCl → 2NaCl + H2
В данной реакции натрий реагирует с соляной кислотой, образуя хлорид натрия и выделяя водородный газ.
Таким образом, свойства щелочных металлов в химических реакциях опredеляют их химическую активность и способность образовывать различные соединения.
Вопрос-ответ

Какие свойства характерны для щелочных металлов?
Щелочные металлы обладают рядом уникальных свойств, таких как высокая реакционная способность, низкая температура плавления, способность образовывать ионы со зарядом +1, а также способность образовывать гидроксиды, различные соединения и сплавы.
Какие именно химические свойства характерны для щелочных металлов?
Щелочные металлы проявляют большую активность в реакциях с водой, воздухом и кислородом. Они способны образовывать щелочные гидроксиды, различные соли, а также гранулы с газообразными элементами, такими как кислород и хлор. Кроме того, они могут проявлять амфотерные свойства, то есть образовывать как кислые (с водой), так и щелочные (с кислородом) оксиды.
