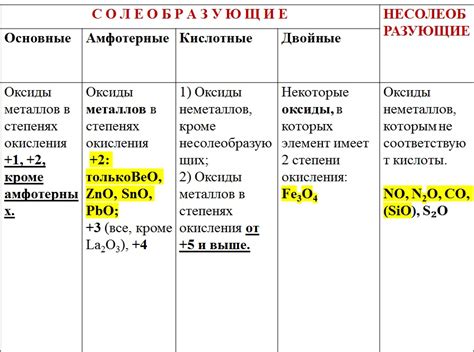
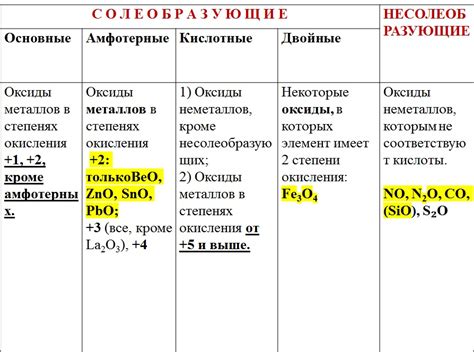
Оксиды Э2О – это соединения, образуемые щелочными металлами, такими как литий, натрий и калий. Они представляют собой химические соединения, состоящие из атомов металла, связанных с атомами кислорода. Оксиды Э2О обладают уникальными свойствами, которые делают их широко используемыми в различных областях человеческой деятельности.
Одним из основных свойств оксидов Э2О является их щелочной характер. Это означает, что они образуют щелочные растворы при контакте с водой. У оксидов щелочных металлов есть высокая способность принимать протоны и образовывать гидроксиды. Благодаря этой способности, оксиды Э2О широко используются в промышленности и лабораторных исследованиях для регулирования pH среды, обработки воды и производства щелочей и щелочных солей.
Кроме своего щелочного характера, оксиды Э2О также обладают другими интересными свойствами. Они являются твердыми, иногда кристаллическими веществами, обладающими высокой термической и электрической проводимостью. Благодаря этим свойствам, оксиды Э2О широко применяются в производстве электроники, керамики, стекла и других материалов.
Оксиды Э2О также имеют биологическое значение. Они являются неотъемлемой частью биологических процессов и включены в состав многих важных биологических соединений, таких как ДНК и белки. Благодаря этому, оксиды Э2О играют важную роль в жизнедеятельности организмов и имеют большое значение для медицины и биотехнологии.
В общем, оксиды Э2О образуются щелочными металлами и обладают уникальными свойствами, делающими их важными в различных областях человеческой деятельности. Благодаря своему щелочному характеру, они широко используются в промышленности, лабораторных исследованиях, а также в медицине и биотехнологии. Оксиды Э2О имеют высокую термическую и электрическую проводимость, что делает их важными в производстве материалов и электроники.
Оксиды э2о образуются щелочными металлами: свойства и применение

1. Свойства
Оксиды э2о, образуемые щелочными металлами, обладают рядом уникальных свойств. Во-первых, они являются щелочными оксидами и способны образовывать растворимые гидроксиды при взаимодействии с водой. Также они обладают высокой степенью основности и могут нейтрализовать кислоты. Кроме того, оксиды э2о могут проявлять амфотерное поведение и взаимодействовать как с кислотами, так и с основаниями.
Во-вторых, оксиды э2о обладают высокой теплопроводностью и электропроводностью. Они облегчают передачу тепла и электричества и широко применяются в производстве электроники и термоэлектрических устройств.
2. Применение
Оксиды э2о, образуемые щелочными металлами, нашли широкое применение в различных областях. В частности, они используются в производстве катализаторов, благодаря своей высокой активности и регенерации после взаимодействия с другими веществами. Также оксиды э2о применяются в производстве стекла, керамики и лакокрасочных материалов, благодаря своей высокой степени термической стойкости и прозрачности. Кроме того, они находят применение в производстве щелочных батарей и аккумуляторов, благодаря своим электропроводным свойствам.
3. Важные представители
Важными представителями оксидов э2о, образуемых щелочными металлами, являются оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O). Все они обладают высокими свойствами и имеют широкий спектр применения в различных отраслях промышленности и науки.
Образование оксидов э2о щелочными металлами
Оксиды э2о являются неорганическими соединениями, образующимися при взаимодействии щелочных металлов с кислородом. Эти металлы включают натрий, калий, литий, рубидий и цезий.
В процессе образования оксидов э2о щелочные металлы активно реагируют с кислородом из воздуха или других источников. При этом металлы окисляются, а кислород значительно увеличивает свою концентрацию.
Образование оксидов э2о щелочными металлами имеет важные практические применения. Они широко используются в промышленности для производства стекла, электролитических растворов и катализаторов. Натрий и калий оксиды также применяются в производстве щелочей и щелочных батарей.
Одним из основных свойств оксидов э2о является их растворимость в воде. При растворении оксиды э2о образуют гидроксиды, которые являются щелочами. Это связано с высокой реакционной способностью щелочных металлов и их способностью образовывать щелочные растворы.
Таким образом, образование оксидов э2о щелочными металлами является важным процессом, имеющим широкое применение в различных областях. Эти соединения играют важную роль в химической промышленности и имеют большое значение для многих технологических процессов.
Свойства оксидов э2о, образованных щелочными металлами
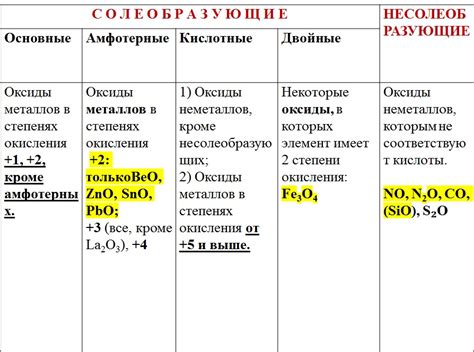
Оксиды э2о, образованные щелочными металлами, обладают рядом характеристических свойств, которые делают их уникальными соединениями. Во-первых, они отличаются высокой растворимостью в воде. Это свойство обусловлено наличием щелочных ионов в своей структуре, которые реагируют с водой и образуют гидроксиды. Такие соединения легко диссоциируют, образуя гидроксидные ионы, что делает оксиды э2о щелочных металлов сильными основаниями.
Во-вторых, оксиды э2о обладают особыми кислотно-основными свойствами. Они могут реагировать как с кислотами, так и с основаниями, образуя соль. Эта реакция называется нейтрализацией. Например, оксид натрия (Na2O), реагируя с кислотой, образует соль и воду:
Na2O + 2HCl → 2NaCl + H2O
В-третьих, оксиды э2о, образованные щелочными металлами, хорошо проводят электричество. Это связано с наличием ионов в их структуре, которые могут двигаться под воздействием электрического поля. Поэтому такие оксиды широко используются в производстве электролитов для аккумуляторных батарей и других электрохимических систем.
Кроме того, оксиды э2о щелочных металлов обладают амфотерными свойствами, то есть они могут реагировать и с кислотами, и с основаниями. Например, оксид калия (K2O) может реагировать как с кислотой, образуя соль и воду, так и с основанием, образуя гидроксид:
K2O + 2HCl → 2KCl + H2O
K2O + 2NaOH → 2KOH + Na2O
Таким образом, свойства оксидов э2о, образованных щелочными металлами, делают их важными соединениями для множества применений в различных отраслях промышленности и науке.
Физические свойства оксидов щелочных металлов
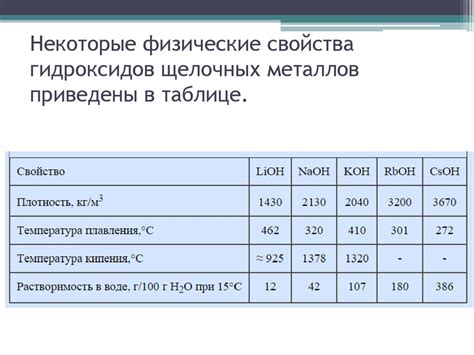
Оксиды щелочных металлов - это соединения, образующиеся при реакции металла с кислородом. При этом образуются прочные и твердые кристаллические соединения, обладающие определенными физическими свойствами.
Точка плавления оксидов щелочных металлов может быть достаточно высокой, например, у оксида натрия - около 1132°C. Это свойство объясняется тем, что в кристаллической решетке оксидов этих металлов имеется множество ионных связей, которые требуют значительной энергии для разрушения и перехода в жидкую фазу.
Плотность оксидов щелочных металлов также обычно высокая. Оксид калия, например, имеет плотность около 2.32 г/см³. Высокая плотность объясняется большим количеством атомов металла и кислорода в единице объема.
Вязкость оксидов щелочных металлов достаточно низкая, что облегчает их использование в различных промышленных процессах. Они легко превращаются в расплавленное состояние и могут быть легко формованы.
Растворимость оксидов щелочных металлов в воде различна в зависимости от конкретного соединения. Некоторые оксиды хорошо растворимы и превращаются в щелочные растворы, а другие плохо растворимы, образуя осадок или нерастворимую глиноземные фазы.
Возможность образования солей - еще одно важное физическое свойство оксидов щелочных металлов. Они могут реагировать с различными кислотами, образуя соли, которые имеют широкое применение в различных областях, таких как промышленность, сельское хозяйство и медицина.
Химические свойства оксидов э2о, образованных щелочными металлами
Оксиды э2о, образованные щелочными металлами, обладают рядом химических свойств, которые делают их важными соединениями в различных областях науки и промышленности.
Одним из ключевых свойств данных соединений является их щелочная реакция, которая проявляется в возможности оксидов э2о реагировать с водой и образовывать соответствующие основания. Эта реакция приводит к образованию гидроксидов щелочных металлов, которые широко используются в различных химических процессах и промышленных производствах.
Кроме того, оксиды э2о образованных щелочными металлами обладают высокой электроотрицательностью, что определяет их способность реагировать с кислородом и другими элементами, образуя разнообразные соединения. Так, оксид натрия (Na2O) образует с кислородом пероксид натрия (Na2O2), который является мощным окислителем и используется в промышленности для производства белил, дезинфицирующих средств и других продуктов.
Также стоит отметить, что оксиды э2о щелочных металлов обладают высокой химической стабильностью и термической устойчивостью. Благодаря этим свойствам, они широко применяются в качестве катализаторов в различных химических процессах, а также в производстве стекла, эмали и керамики.
Применение оксидов э2о, образованных щелочными металлами

Оксиды э2о, образованные щелочными металлами, нашли широкое применение в различных отраслях промышленности и научных исследований. Благодаря своим уникальным свойствам, они стали неотъемлемой частью многих процессов и материалов.
Одним из основных применений оксидов э2о является их использование в качестве катализаторов. Они способны ускорять химические реакции, позволяя снизить температуру и время процесса. Благодаря этому, оксиды э2о можно найти в производстве пластмасс, в качестве катализаторов в различных химических процессах и в производстве промышленных газов.
Ещё одной областью применения оксидов э2о является электроника. Благодаря своей высокой проводимости, они используются в качестве полупроводниковых материалов. Они находят применение в изготовлении солнечных батарей, транзисторов и других электронных устройств.
Кроме того, оксиды э2о широко применяются в медицине. Они обладают антимикробными и противовоспалительными свойствами, что делает их ценными компонентами при создании лекарственных препаратов. Они могут использоваться как антисептики при лечении ран и гнойных инфекций, а также как основа для создания лекарственных препаратов.
Перспективы применения оксидов э2о, образованных щелочными металлами
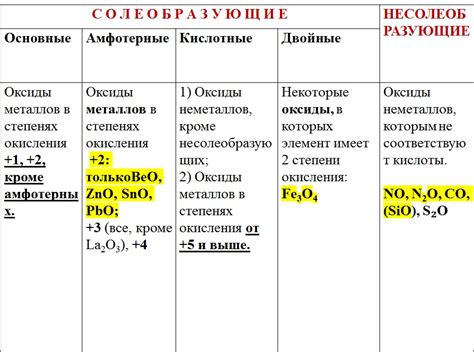
Оксиды э2о, образованные щелочными металлами, представляют собой важные вещества с широким спектром применений. Их использование в различных отраслях промышленности и научных исследованиях обусловлено их уникальными свойствами и высокой эффективностью.
Одной из перспектив применения таких оксидов является область катализа. Щелочные металлы образуют стабильные оксидные фазы, которые могут служить активными катализаторами в различных процессах. Они способны ускорять скорость реакций и повышать выход продуктов, что делает их незаменимыми в промышленности.
Оксиды э2о, образованные щелочными металлами, также отличаются высокой химической стойкостью и термической устойчивостью. Это позволяет использовать их в производстве огнеупорных материалов, как например, в производстве огнеупорных кирпичей и стекол. Они обладают высокой теплопроводностью и стабильностью при высоких температурах.
Применение оксидов э2о, образованных щелочными металлами, также находит свое применение в электрохимии. Они способны выступать как суперконденсаторы, батареи и аккумуляторы. Благодаря своим уникальным свойствам, они могут обеспечить высокую энергоемкость и длительное время работы электрохимических устройств.
Наконец, исследования показывают перспективы использования оксидов э2о, образованных щелочными металлами, в области косметики и медицины. Их применение может быть связано с их антибактериальными свойствами и способностью стимулировать регенерацию тканей. Это открывает новые возможности для разработки новых препаратов и косметических продуктов.
Вопрос-ответ

Какие свойства имеют оксиды э2о, образующиеся щелочными металлами?
Оксиды э2о, образующиеся щелочными металлами, обладают рядом характерных свойств: они обладают щелочным характером, то есть растворяются в воде, образуя щелочные растворы; они растворяются в кислотах, образуя соли и воду; они обладают высокой теплопроводностью и электропроводностью; они являются химически активными соединениями, способными к реакциям окисления и восстановления.
Какие применения имеют оксиды э2о, образующиеся щелочными металлами?
Оксиды э2о, образующиеся щелочными металлами, имеют широкий спектр применений. Они используются в производстве стекла и керамики, в производстве щелочей, катализаторов и других химических соединений. Они также применяются в медицине, сельском хозяйстве и в процессах очистки воды.
