Щелочные металлы – это элементы периодической таблицы, которые относятся к первой группе. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают высокой химической реактивностью и характеризуются наличием одной электронной оболочки.
Образование двухатомных молекул щелочных металлов имеет свои особенности. Каждый элемент первой группы стремится к достижению стабильной электронной конфигурации, заполнив свою внешнюю электронную оболочку. Для этого два металла могут образовать ковалентную связь, поделив пару электронов между собой.
Например, литий (Li) образует молекулы Li2. Когда два атома лития встречаются, они могут обменять один электрон и образовать стабильную молекулу Li2. Это происходит потому, что каждый атом лития имеет один электрон в своей внешней оболочке, и обмен электронами позволяет обоим атомам достичь стабильной электронной конфигурации.
Таким образом, образование двухатомных молекул щелочных металлов является результатом стремления элементов первой группы к достижению стабильной электронной конфигурации путем обмена электронами. Это явление имеет важное значение для понимания химических свойств щелочных металлов и их роли в различных химических реакциях.
Особенности реакции щелочных металлов
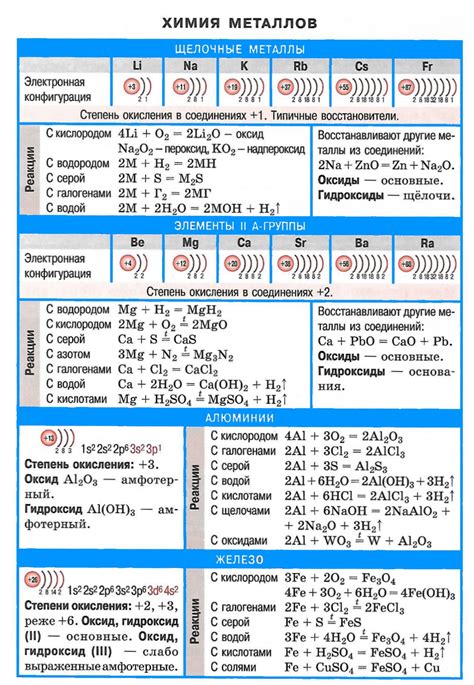
Щелочные металлы, такие как литий, натрий и калий, обладают высокой реактивностью и способностью образовывать двухатомные молекулы. Это объясняется их низкой ионизационной энергией и большой электроотрицательностью.
Во время реакции с другими элементами, щелочные металлы активно отдают свой внешний электрон, образуя положительный ион. Это происходит из-за их небольшого радиуса и большой силы притяжения ядра к электрону.
Одной из особенностей реакции щелочных металлов является образование двухатомных молекул. При нагревании щелочного металла образуется пар, который при достаточно высокой температуре может конденсироваться и образовать молекулы.
Например, при нагревании лития до высокой температуры образуется пар, из которого могут образовываться двухатомные молекулы Li2. Это связано с тем, что атомы лития имеют один внешний электрон, который может образовывать связи с другими атомами.
Особенности реакции щелочных металлов можно проиллюстрировать с помощью таблицы. По вертикали таблицы указаны щелочные металлы, а по горизонтали - процессы их реакции с другими элементами. Каждая ячейка таблицы содержит информацию о конкретной реакции щелочного металла.
| Реакция 1 | Реакция 2 | Реакция 3 | |
|---|---|---|---|
| Литий | Молекула Li2 образуется при нагревании | ... | ... |
| Натрий | ... | ... | ... |
| Калий | ... | ... | ... |
Таким образом, реакция щелочных металлов характеризуется их высокой реактивностью и способностью образовывать двухатомные молекулы при нагревании. Это делает их важными в химической промышленности и научных исследованиях.
Изучение образования двухатомных молекул

Исследование образования двухатомных молекул щелочных металлов является важной темой в физической и химической науке. Это явление может быть объяснено с использованием квантовой механики, и оно имеет значительное практическое значение в различных областях науки и технологии.
Двухатомные молекулы щелочных металлов образуются при взаимодействии двух атомов, которые обладают непарным электроном в своей валентной оболочке. Электронные конфигурации и свойства атомов щелочных металлов позволяют им образовывать устойчивые двухатомные молекулы.
Изучение этого явления проводится с использованием различных экспериментальных методов, таких как спектроскопия, масс-спектрометрия, ультрафиолетовая и видимая спектроскопия. Обработка данных, полученных при помощи этих методов, позволяет определить структуру и свойства двухатомных молекул щелочных металлов, а также их электронную структуру и энергетические уровни.
Изучение образования двухатомных молекул щелочных металлов имеет широкий диапазон применений. Например, эти молекулы могут использоваться в качестве катализаторов для важных химических реакций или в электронике для создания новых материалов с определенными свойствами. Понимание процесса образования и свойств двухатомных молекул щелочных металлов является ключевым для развития новых технологий и научных открытий.
Методы исследования в области молекулярной физики

Молекулярная физика - это наука, изучающая структуру, свойства и поведение молекул. Для исследования молекул и их взаимодействий существуют различные методы, которые позволяют получить информацию о состоянии и динамике молекул.
Одним из основных методов исследования является спектроскопия. Спектроскопия позволяет изучать взаимодействие молекул с электромагнитным излучением. Спектры поглощения, рассеяния или испускания света молекулами предоставляют информацию о их состоянии и структуре.
Для изучения структуры молекул и их взаимодействия существует также метод рентгеноструктурного анализа. С его помощью можно определить расположение атомов внутри молекулы и получить трехмерную структуру. Рентгеноструктурный анализ важен для понимания основных физико-химических свойств молекул и процессов, происходящих в них.
Другим распространенным методом исследования в области молекулярной физики является масс-спектрометрия. Она позволяет определить массу и состав молекулы, идентифицировать различные компоненты смесей и изучать процессы разложения или реакции молекул. Масс-спектрометрия широко применяется в аналитической химии и биохимии для идентификации различных веществ.
В области молекулярной физики также используются компьютерные моделирования. С их помощью можно вычислительно исследовать свойства и поведение молекул, предсказать новые структуры или процессы. Компьютерные моделирования позволяют экономить время и ресурсы, и улучшить понимание молекулярных систем.
Таким образом, методы исследования в области молекулярной физики включают спектроскопию, рентгеноструктурный анализ, масс-спектрометрию и компьютерные моделирования. Комбинирование этих методов позволяет получить полную информацию о структуре и свойствах молекул, что необходимо для понимания их роли в различных физических и химических процессах.
Применение двухатомных молекул в науке и промышленности

Двухатомные молекулы, состоящие из щелочных металлов, имеют широкий спектр применений в науке и промышленности. Одним из наиболее известных использований таких молекул является их применение в поляриметрии и спектроскопии. Благодаря своей химической активности и высокой реакционной способности, двухатомные молекулы щелочных металлов находят применение в качестве точечных источников света, используемых в различных аналитических методах исследования.
Еще одним важным применением двухатомных молекул щелочных металлов является их использование в процессах получения редкоземельных металлов. Благодаря способности щелочных металлов образовывать стабильные соединения с другими элементами, такие молекулы могут использоваться в химическом синтезе и для разделения редкоземельных элементов из руды. Это позволяет повысить эффективность процесса получения редкоземельных металлов и уменьшить количество химических реагентов, необходимых для его осуществления.
Кроме того, двухатомные молекулы щелочных металлов нашли применение в промышленности в качестве катализаторов в реакциях полимеризации и органического синтеза. Благодаря своей химической активности и способности участвовать в различных реакциях обмена, эти молекулы могут ускорять химические процессы и повышать производительность реакционной смеси. Такое применение двухатомных молекул щелочных металлов позволяет снизить затраты на производство различных органических соединений и улучшить их качество.
Таким образом, двухатомные молекулы щелочных металлов находят широкое применение в науке и промышленности. Они используются для анализа различных веществ, разделения редкоземельных элементов и ускорения химических реакций. Это позволяет улучшить эффективность и энергетическую эффективность различных процессов и химических производств.
Вопрос-ответ

Какие щелочные металлы образуют двухатомные молекулы?
Двухатомные молекулы образуют только литий (Li2), натрий (Na2), калий (K2), рубидий (Rb2) и цезий (Cs2).
Почему двухатомные молекулы образуются только у некоторых щелочных металлов?
Образование двухатомных молекул связано с электронной структурой атомов щелочных металлов. Литий, натрий, калий, рубидий и цезий имеют одну свободную валентную электрон, которая может участвовать в образовании химических связей. Этот фактор позволяет им образовывать двухатомные молекулы, в отличие от других щелочных металлов, у которых эта свободная валентная электронная оболочка отсутствует.
