Щелочные металлы представляют собой группу химических элементов, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы и обладают рядом общих свойств, которые делают их уникальными и востребованными в различных отраслях науки и техники.
Первым щелочным металлом, который был открыт, является калий. Это произошло в 1807 году благодаря химику и физику Сэр Хамфри Дэви, который проводил эксперименты с гальваническими элементами и смог выделить чистый калий из гидроксида.
Одной из самых важных характеристик щелочных металлов является их низкая плотность и удельный вес, которые делают их легкими и подвижными. Они также обладают высокой температурой плавления и кипения, что делает их непригодными для использования в высокотемпературных условиях.
Щелочные металлы обладают сильной активностью и реактивностью, поэтому они редко встречаются в природе в чистом виде. Чаще всего они присутствуют в соединениях с другими элементами, такими как кислород, вода и галогены.
Основное применение щелочных металлов связано с их химическими и физическими свойствами. Например, они широко используются в производстве щелочных и щелочно-земельных сплавов, которые применяются в металлургии, электротехнике и химической промышленности.
Что такое щелочные металлы?
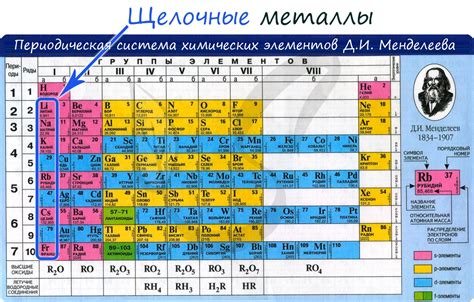
Щелочные металлы – это элементы первой группы периодической таблицы Менделеева. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к более реактивной группе элементов и часто проявляют характерные химические свойства.
Щелочные металлы характеризуются низкой плотностью, мягкостью и низкой температурой плавления. Они отличаются высокой реактивностью и легко вступают в химические реакции с другими элементами. Эти металлы обладают способностью образовывать ионные соединения с отрицательно заряженными анионами, такими как галогены, кислород и сера.
Щелочные металлы широко используются в различных областях. Например, калий и натрий являются важными элементами пищевой промышленности, где они используются в качестве добавок в пищевые продукты. Литий находит применение в производстве аккумуляторов для электромобилей и портативных электронных устройств. Рубидий и цезий используются в научных исследованиях и в производстве электронной аппаратуры.
Уникальные свойства щелочных металлов

1. Высокая активность и реактивность: Щелочные металлы, такие как литий, натрий и калий, обладают высокой активностью и реактивностью. Они легко реагируют с водой, кислородом и другими веществами, что делает их ценными в различных химических процессах и реакциях.
2. Низкая плотность: Щелочные металлы обладают низкой плотностью, что делает их легкими и удобными для использования в различных приложениях. Например, литий широко используется в легких аккумуляторах, а калий - в производстве удобрений.
3. Низкая температура плавления и кипения: У щелочных металлов низкая температура плавления и кипения, что делает их легко переводимыми в жидкое состояние. Это свойство позволяет использовать их в различных процессах плавки и смешения веществ.
4. Высокая проводимость электричества и тепла: Щелочные металлы обладают высокой проводимостью электричества и тепла. Это свойство делает их полезными для создания электрических проводов и теплопроводных материалов.
5. Образование химически стабильных соединений: Щелочные металлы могут образовывать химически стабильные соединения с другими элементами. Это позволяет использовать их в различных химических процессах, включая производство стекла, удобрений и промышленных реагентов.
6. Изотопы и радиоактивность: Некоторые щелочные металлы, такие как калий и цезий, имеют радиоактивные изотопы. Это свойство позволяет использовать их в ядерной энергетике и научных исследованиях.
В целом, уникальные свойства щелочных металлов делают их важными компонентами в различных областях науки и технологии. Их способность к реакции и образованию стабильных соединений открывает широкие перспективы использования в химической промышленности, энергетике и других отраслях.
Основные свойства щелочных металлов

1. Активность
Щелочные металлы характеризуются высокой активностью. Они легко вступают в химические реакции с другими веществами, особенно с кислотами и водой, выделяя при этом значительное количество тепла. Поэтому щелочные металлы хранятся в специальных контейнерах, чтобы предотвратить их контакт с кислородом и влагой в воздухе.
2. Мягкость и низкая плотность
Щелочные металлы обладают мягкостью и низкой плотностью. Например, натрий и калий можно резать ножом, а литий является самым легким металлом. Такие свойства обусловлены слабой связью между атомами металлов в кристаллической решетке.
3. Электропроводность
Щелочные металлы хорошие электропроводники. Из-за своей структуры, металлы способны передавать электроны свободно внутри своей решетки. Это позволяет использовать щелочные металлы в производстве электронных устройств и аккумуляторов.
4. Оксидационная способность
Щелочные металлы обладают высокой оксидационной способностью, то есть они легко образуют оксиды. При контакте с воздухом они покрываются слоем оксидной плёнки, что приводит к их быстрому окислению и образованию окислов.
5. Применение
Из-за своих уникальных свойств, щелочные металлы находят широкое применение в различных отраслях. Калий используется в сельском хозяйстве для удобрений, натрий - в производстве стекла и мыла, а литий - в производстве аккумуляторов для мобильных устройств и электромобилей.
Активность щелочных металлов
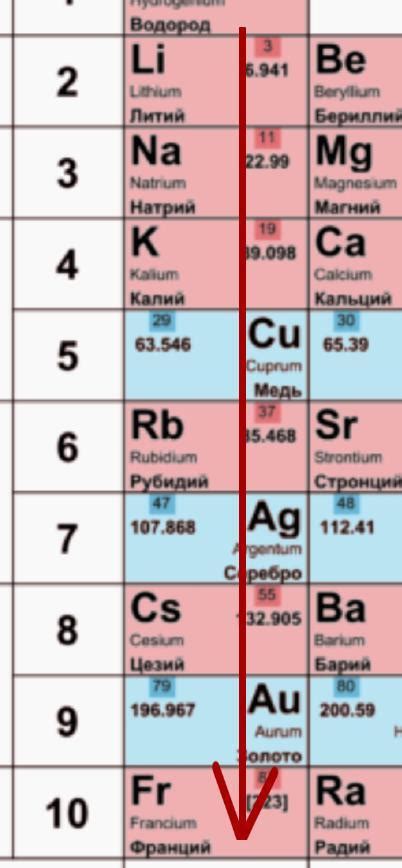
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, характеризуются высокой активностью. Эта активность связана с их способностью легко отдавать электроны, образуя ионы положительного заряда.
Степень активности щелочных металлов возрастает по мере движения по периоду таблицы Mendeleevа, от лития к цезию. Наиболее активным щелочным металлом является цезий, а наименее активным – литий.
Активность щелочных металлов проявляется в их реакции с водой. При контакте с водой щелочные металлы активно реагируют, выделяя водород и образуя щелочную среду. Эта реакция проходит очень быстро и сопровождается высвобождением большого количества энергии.
Также щелочные металлы проявляют активность при взаимодействии с кислородом. При контакте с воздухом они образуют окисленные соединения, такие как оксиды или пероксиды.
Из-за своей высокой активности щелочные металлы широко используются в различных областях. Например, их соли применяются в стекольной, керамической и химической промышленности. Щелочные металлы также используются в производстве щелочных батарей и алкалиновых аккумуляторов.
Однако активность щелочных металлов требует особой осторожности при работе с ними, так как они очень реактивны и могут вызывать ожоги или взрывы при неправильном обращении.
Электроотрицательность щелочных металлов
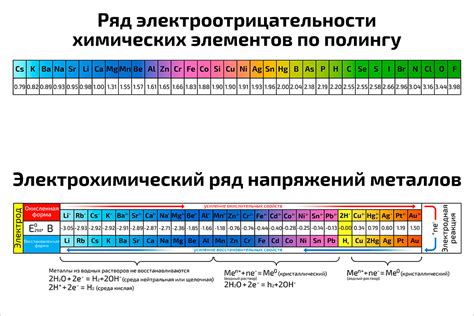
Электроотрицательность - это число, характеризующее способность атома притягивать электроны в химической связи. Чем выше значение электроотрицательности, тем сильнее атом притягивает электроны.
Для щелочных металлов, таких как литий, натрий, калий и др., характерно низкое значение электроотрицательности. Они относятся к самым электроотрицательным элементам в периодической системе.
Это объясняется тем, что у атомов щелочных металлов малое количество электронов на внешнем энергетическом уровне, что делает их более склонными к отдаче электронов, чем к их притяжению. Из-за этого щелочные металлы активно реагируют с другими элементами, образуя соединения и ионы.
Поэтому щелочные металлы хорошо растворяются в воде, образуя щелочные растворы. Они также легко образуют ионы с положительным зарядом, освобождая электроны в химических реакциях. Это делает щелочные металлы важными компонентами в различных промышленных процессах и технологиях.
Плотность и температура плавления щелочных металлов
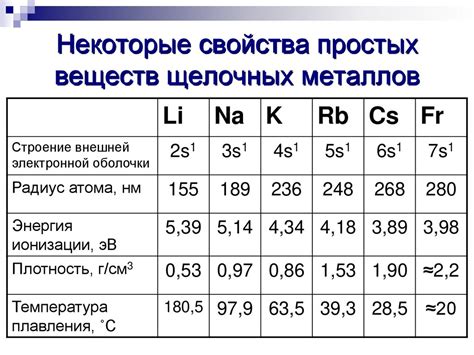
Щелочные металлы являются группой элементов, которые включают литий, натрий, калий, рубидий, цезий и франций. Они имеют низкую плотность и низкую температуру плавления, что делает их особенно интересными для различных промышленных и научных применений.
Плотность щелочных металлов относительно низкая по сравнению с другими металлами. Например, плотность лития составляет около 0,53 г/см³, что делает его легче многих других металлов. Калий и натрий имеют плотность около 0,86 и 0,97 г/см³ соответственно. Эти низкие значения плотности позволяют щелочным металлам быть легкими и подвижными в различных средах.
Температура плавления щелочных металлов также относительно низкая. Литий плавится при примерно 180°C, натрий при около 98°C, калий при 63°C, рубидий при 39°C и цезий при всего лишь 28°C. Это означает, что щелочные металлы могут быть легко расплавлены и использованы в различных процессах с низкими температурами.
Из-за их низкой плотности и низкой температуры плавления, щелочные металлы находят широкое применение в различных областях. Например, они используются для производства легких конструкций, литий-ионных батарей, космических аппаратов, ламп накаливания и других электронных устройств. Они также используются в химической промышленности, при производстве протонной терапии и в многих других областях науки и техники.
Применение щелочных металлов

Натрий имеет широкое применение в пищевой промышленности, где используется как консервант и регулятор кислотности. Он также находит применение в производстве стекла, мыла, моющих средств, алюминия и кожи. Натрий используется в щелочных батареях и является важным компонентом многих фармацевтических препаратов.
Калий широко используется в сельском хозяйстве как удобрение, поскольку он является важным макроэлементом для растений. Калий также применяется в производстве стекла, мыла, удобрений, взрывчатых веществ и лекарств. Он играет важную роль в функционировании нервной системы и мышц.
Литий находит применение в производстве аккумуляторов, в особенности литий-ионных аккумуляторов, которые широко применяются в мобильных устройствах, электромобилях и робототехнике. Литий также используется в производстве стекла, керамики и лекарственных препаратов.
Рубидий применяется в электронике и оптике, в производстве лазеров и фоточувствительных элементов. Он также используется в металлургии для улучшения высокотемпературной стойкости сплавов. Рубидий имеет применение в научных исследованиях, в особенности в атомной физике и лазерных технологиях.
Цезий находит свое применение в научных исследованиях и высокоточной технике. Он используется в атомных часах, нуклеарных реакторах и в лазерной спектроскопии. Цезий широко применяется в медицине для лечения рака и главных шейных артерий.
Франций является самым редким и реактивным из всех щелочных металлов. Из-за его высокой реактивности и короткого срока полураспада, у него нет широкого промышленного применения. Однако францием можно управлять радиоактивными источниками, применять в физических экспериментах и научных исследованиях о природе ядра.
Использование щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, широко используются в различных отраслях промышленности благодаря своим уникальным свойствам.
Литий применяется в производстве аккумуляторных батарей, в особенности для электромобилей. Благодаря своей низкой плотности и высокой энергетической плотности, литиевые ионные аккумуляторы являются эффективным источником энергии.
Натрий используется в процессе хлорирования для производства хлорида натрия, который далее применяется в производстве щелочей, стекла и многих других химических соединений. Кроме того, натрий находит применение в производстве пищевых добавок, фармацевтических препаратов и моющих средств.
Калий используется в сельском хозяйстве в виде удобрений. Калийные удобрения вносятся в почву для повышения урожайности культур, таких как зерновые, овощи и фрукты. Кроме того, калий применяется в производстве стекла, мыла, красителей и лекарственных средств.
Рубидий используется в оптике и электронике. Благодаря своей способности к поглощению радиации, рубидий применяется в изготовлении фотоэлементов и детекторов. Он также используется в производстве лазеров и тепловизоров.
Цезий находит применение в ядерной промышленности. Цезиевые соединения используются для создания ионов цезия, которые служат источниками радиоактивности в ядерных реакторах и медицинской диагностике.
В целом, щелочные металлы играют важную роль в промышленности благодаря своим химическим и физическим свойствам. Их широкое использование способствует развитию различных отраслей, таких как энергетика, химия, сельское хозяйство и медицина.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы обладают несколькими основными свойствами. Во-первых, они очень реактивны и легко реагируют с водой и кислородом. Во-вторых, они имеют низкую плотность и низкую точку плавления, что делает их легкими металлами. Они также имеют низкую твердость и хорошую электропроводность. Кроме того, щелочные металлы обладают яркими цветами и могут быть использованы в пиротехнике.
Где применяются щелочные металлы?
Щелочные металлы имеют широкий спектр применения. Например, натрий и калий широко используются в пищевой промышленности и в производстве стекла. Литий находит применение в различных электронных устройствах, таких как мобильные телефоны и ноутбуки. Калий также используется в удобрениях, так как является необходимым питательным элементом для растений. Щелочные металлы также применяются в производстве щелочных батарей, амортизаторах и лампах.
