Щелочные металлы, включающие литий, натрий, калий, рубидий и цезий, являются группой элементов, характеризующихся высокой активностью и амфотерными свойствами. Эти элементы обладают уникальными кислотно-восстановительными свойствами, которые обеспечивают широкий спектр их применения в различных сферах науки и техники.
Одной из главных особенностей щелочных металлов является их реактивность с водой, при которой происходит выделение водорода и образование гидроксидов. Это позволяет использовать их в процессе производства гидрогенированных продуктов, а также в водородной энергетике. Кроме того, щелочные металлы являются важными компонентами катализаторов ряда химических реакций, как в промышленности, так и в лабораторных условиях.
Важной областью применения щелочных металлов является электрохимия. Благодаря своим кислотно-восстановительным свойствам, щелочные металлы применяются в изготовлении ионных литиевых и натриевых батарей, которые широко используются в электронике и транспорте. Кроме того, переходные металлы играют важную роль в разработке и создании электролитов и компонентов для солнечных батарей и водородных топливных элементов.
Щелочные металлы также широко применяются в металлургии, где они используются для получения качественных сплавов и металлов, а также в процессе очистки от примесей и удаления кислорода из металлических руд.
В заключение, щелочные металлы являются важными элементами в научных и технических исследованиях, благодаря своим кислотно-восстановительным свойствам, которые обеспечивают широкий спектр их применения. Они играют ключевую роль в различных отраслях, от электрохимии до металлургии, и продолжают быть объектом активных исследований для создания новых и усовершенствования существующих технологий и материалов.
Свойства и применение щелочных металлов

Щелочные металлы - это элементы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть ряд уникальных свойств, связанных с их кислотно-восстановительными свойствами и высокой активностью.
Одним из важных свойств щелочных металлов является высокая реактивность. Они быстро реагируют с водой, образуя щелочные растворы и выделяя водород. Кроме того, щелочные металлы образуют легко растворимые кислотообразующие оксиды и гидроксиды.
Щелочные металлы широко применяются в различных отраслях промышленности. Например, калий используется в производстве удобрений, литий применяется в производстве литиевых батарей и лекарственных препаратов. Натрий используется в пищевой промышленности для приготовления соли и пищевых добавок. Рубидий и цезий используются в научных исследованиях и в производстве оптических устройств.
Щелочные металлы также применяются в различных технологиях. Например, калий используется в производстве стекла, натрий - в производстве щелочных элементов, а литий - в производстве аккумуляторов и электронных устройств.
В заключение, щелочные металлы обладают уникальными свойствами, которые находят широкое применение в различных отраслях науки, промышленности и технологий. Их высокая реактивность и кислотно-восстановительные свойства делают их незаменимыми во многих процессах и производствах.
Щелочные металлы - кислотно-восстановительные свойства и их значение
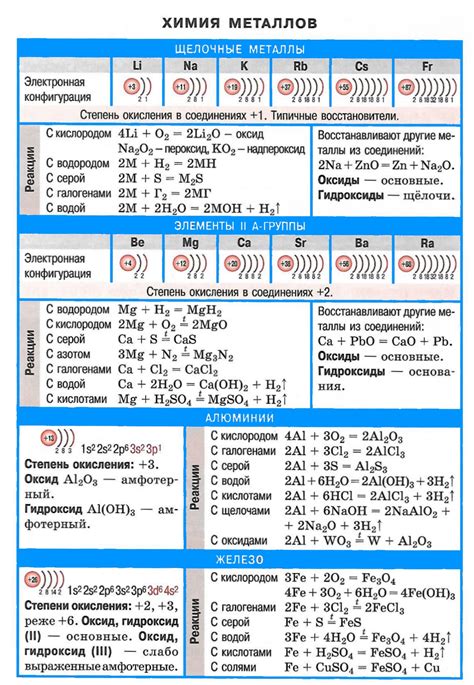
Щелочные металлы - это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой химической активностью и обладают кислотно-восстановительными свойствами.
Кислотно-восстановительные свойства щелочных металлов заключаются в том, что они способны реагировать с кислотами и образовывать соли. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению водорода:
2Na + 2HCl → 2NaCl + H2↑
Кроме того, щелочные металлы проявляют свои кислотно-восстановительные свойства в реакциях с водой. Они образуют щелочную среду и выделяют водород. Например, реакция натрия с водой протекает следующим образом:
2Na + 2H2O → 2NaOH + H2↑
Значение кислотно-восстановительных свойств щелочных металлов заключается в их широком применении в различных областях. Например, щелочные металлы используются в производстве щелочей, жидких и твердых мыл, стекол и керамики. Они также применяются в металлургии, батарейках, фармацевтической и пищевой промышленности. Кроме того, некоторые щелочные металлы, такие как литий, находят применение в производстве лекарств и аккумуляторов.
Применение щелочных металлов в различных отраслях

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое применение в различных отраслях. Их кислотно-восстановительные свойства дают им возможность использоваться в составе различных химических реактивов и процессов.
Металлы этой группы активно используются в производстве аккумуляторов, особенно литиевых. Литий-ионные аккумуляторы широко применяются в мобильных устройствах, таких как смартфоны и ноутбуки, благодаря своей высокой энергетической плотности и длительному сроку службы.
Один из самых распространенных примеров использования щелочных металлов - это натрий в пищевой промышленности для приготовления пищевых добавок и консервирования продуктов. Натрий гидроксид используются для регулирования pH в продуктах, а также для производства мыла и моющих средств. Натрий также применяется для обезжиривания и дезинфекции поверхностей в пищевой и фармацевтической промышленности.
Калий широко используется в сельском хозяйстве в качестве удобрения. Он содержится во многих минералах и зачастую добавляется к почве для улучшения роста и качества растений. Калийные соединения также применяются в производстве стекла, мыла и пластмасс.
В фармацевтической отрасли щелочные металлы используются для производства лекарственных препаратов. Например, литий используется в лекарствах для лечения психических расстройств, а натрий гидроксид применяется для регулирования pH в препаратах.
Еще одним примером применения щелочных металлов является их использование в ядерной энергетике. Калий-40 используется в реакторах для управления и контроля процесса расщепления ядерных реакторов. Также, натрий-калиевый сплав применяется в системах охлаждения ядерных реакторов благодаря своим теплоносительным свойствам.
В целом, использование щелочных металлов в различных отраслях является неотъемлемой частью современных технологий и производственных процессов, обеспечивая эффективность и надежность в различных областях.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы обладают высокой щелочностью и активностью. Они активно реагируют с кислородом, водой, кислотами и многими веществами, проявляя кислотно-восстановительные свойства.
Какие вещества могут быть окислены щелочными металлами?
Щелочные металлы могут окислять такие вещества, как кислород, водород и неметаллы. Они способны выступать в качестве сильных восстановителей и участвовать во многих химических реакциях.
Какие применения имеют щелочные металлы?
Щелочные металлы широко используются в различных отраслях промышленности. Они являются важными компонентами в производстве щелочей, гидроксидов, сплавов и других химических соединений. Они также используются в производстве батарей, стекла, шампуней и других бытовых товаров.
