Восстановительное взаимодействие щелочных металлов - это процесс, при котором атомы или ионы щелочных металлов передают электроны другим веществам, в результате чего сами становятся окисленными. Это явление имеет широкое применение в различных областях науки и техники и является одной из основных химических реакций, происходящих с участием щелочных металлов.
Щелочные металлы, включающие литий, натрий, калий, рубидий, цезий и франций, обладают химической активностью, благодаря которой они способны вступать во взаимодействие с различными веществами. Их восстановительное действие обусловлено наличием одного свободного электрона в внешней электронной оболочке, что делает их легко окисляемыми и хорошими донорами электронов.
Примером восстановительного взаимодействия щелочных металлов может служить их реакция с водой. При этом каждый металл передает один электрон молекуле воды, что приводит к образованию гидроксида металла и выделению водорода. Эта реакция широко используется в производстве водорода, а также в батареях и других устройствах, основанных на электрохимических процессах.
Восстановительное взаимодействие щелочных металлов также находит применение в органической химии. В реакциях восстановления щелочные металлы могут служить мощными восстановителями, способными передать электроны молекулам органических соединений и изменить их структуру и свойства. Это обуславливает использование щелочных металлов как катализаторов в различных химических процессах, в том числе в производстве фармацевтических препаратов и пластиков.
В заключение, восстановительное взаимодействие щелочных металлов представляет собой важный и широко применяемый химический процесс. Главной особенностью этого взаимодействия является способность металлов передавать электроны другим веществам, что позволяет им играть роль восстановителей в различных реакциях. Знание и изучение восстановительного взаимодействия щелочных металлов имеет большое значение для развития современной науки и технологий, а также для создания новых материалов и веществ, имеющих широкий спектр применения.
Большое значение щелочных металлов
Щелочные металлы занимают особое место в химическом мире. Они представляют из себя группу металлов, включающую литий, натрий, калий, рубидий, цезий и франций. Благодаря своим уникальным свойствам и широкому применению, эти элементы становятся незаменимыми в различных сферах человеческой деятельности.
Во-первых, щелочные металлы широко используются в производстве щелочных жидкостей и щелочных солей. Они активно применяются в бытовой химии, косметике и фармацевтике. Благодаря своей щелочной природе, они являются основой для многих моющих средств, а также используются для регулировки pH-баланса в различных продуктах.
Во-вторых, щелочные металлы широко используются в энергетической отрасли. Благодаря своим высоким электрохимическим свойствам, они являются идеальными материалами для производства алкалиновых элементов. Эти элементы используются в батареях и аккумуляторах, обеспечивая энергией различные портативные устройства, электромобили и даже космические аппараты.
В-третьих, щелочные металлы находят широкое применение в научных исследованиях и медицине. Они используются для создания различных лекарственных препаратов, диагностических средств и радиоизотопов. Благодаря своей высокой реакционной способности и способности образовывать соли, щелочные металлы играют важную роль в медицинской практике, анализе окружающей среды и атомной энергетике.
В заключение, щелочные металлы имеют огромное значение в различных областях науки и технологии. Их уникальные свойства и возможности делают их незаменимыми материалами в производстве, энергетике и медицине. Без них было бы невозможным современное развитие наших технологий и достижений в различных отраслях деятельности. Поэтому понимание и изучение свойств щелочных металлов играет важную роль в развитии науки и промышленности.
Зачем нужны щелочные металлы?

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в различных сферах человеческой деятельности благодаря своим уникальным свойствам и химической активности.
Во-первых, щелочные металлы широко используются в производстве аккумуляторов, поскольку они обладают высокой электрохимической активностью и способны эффективно хранить и отдавать энергию. Например, литиевые и ионно-литиевые аккумуляторы широко применяются в мобильных устройствах и электромобилях благодаря своей высокой энергетической плотности.
Во-вторых, эти металлы используются в производстве различных материалов, таких как стекло, керамика и сплавы. Натрий, калий и другие щелочные металлы добавляются в стекло и керамические материалы для придания им специфических свойств, например, прозрачности или устойчивости к высоким температурам. Кроме того, калий часто используется в сплавах с алюминием и магнием для повышения их прочности и устойчивости к коррозии.
Также щелочные металлы являются важными элементами в биологических системах. Они играют роль электролитов, регулирующих водный баланс и проводящих электрические импульсы в организме. Калий, например, необходим для нормального функционирования мышц и нервной системы. Щелочные металлы также используются в медицине, в процессе проведения диагностических исследований и лечения различных заболеваний.
Роль щелочных металлов в организме

Щелочные металлы, такие как натрий, калий и литий, играют важную роль в организме человека. Они являются необходимыми элементами для поддержания нормальной работы многих биологических процессов.
Натрий является одним из основных ионов внутриклеточной и внеклеточной жидкости. Он участвует в регуляции осмотического давления, водного баланса и кислотно-щелочного равновесия организма. Натрий также играет важную роль в передаче нервных импульсов и сокращении мышц.
Калий также является ключевым элементом для нормальной функции организма. Он участвует в регуляции сердечного ритма, уровня кровяного давления и сокращении мышц. Калий также влияет на обмен веществ, участвует в синтезе белков и передаче нервных импульсов.
В отличие от натрия и калия, литий в организме находится в гораздо меньших количествах. Однако его роль также значительна. Литий участвует в регуляции настроения и предотвращении депрессивных состояний. Также он может оказывать антиоксидантное и противоопухолевое действие.
В целом, щелочные металлы играют важную роль в поддержании нормального функционирования организма. В случае недостатка или избытка этих элементов могут возникать различные проблемы со здоровьем. Поэтому важно поддерживать баланс их уровня в организме через правильное питание и при необходимости прием специальных препаратов.
Особенности взаимодействия щелочных металлов с водой

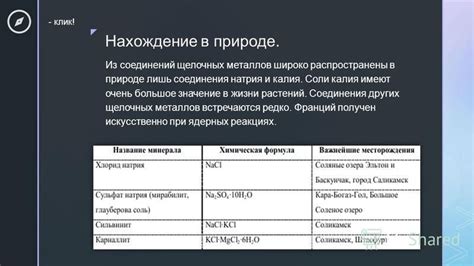
Щелочные металлы – это элементы первой группы периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Взаимодействие этих металлов с водой является одним из самых изученных явлений в химии.
При контакте с водой щелочные металлы проявляют сильную реактивность, что обусловлено их способностью образовывать ионные соединения. Во время взаимодействия с водой происходит образование гидроксидов металлов, выделяется водород и возникает сильно щелочная среда.
Порядок реакции с водой у щелочных металлов возрастает по группе, то есть литий реагирует с водой самым интенсивно, а франций – наименее интенсивно. Это связано с увеличением радиуса атома и уменьшением его ионизационной энергии.
Реакция между щелочными металлами и водой протекает очень быстро. Литий, например, реагирует с водой с выделением большого количества тепла, что наблюдается в виде пламени. Натрий, калий и другие щелочные металлы также вызывают яркое горение и делают воду очень щелочной.
- Реакция между щелочными металлами и водой является экзотермической, то есть сопровождается выделением тепла.
- В результате взаимодействия с водой образуются гидроксиды щелочных металлов, которые хорошо растворимы в воде.
- Водород, образующийся при реакции, обладает рядом полезных свойств и широко используется в промышленности и научных исследованиях.
Реакция щелочных металлов с водой может быть опасной и требует соблюдения особых мер предосторожности. При этом она является интересным объектом изучения и имеет важное значение в различных областях науки и технологии.
Способы восстановления щелочных металлов

Щелочные металлы являются очень активными элементами и легко взаимодействуют с другими веществами. В процессе таких реакций они часто окисляются и теряют свою металлическую природу. Однако существуют способы восстановления щелочных металлов, чтобы вернуть им металлические свойства.
Одним из способов восстановления щелочных металлов является электролиз. При этом методе вещество подвергается электрическому току, который позволяет вернуть металлические свойства щелочного металла. Например, литий может быть восстановлен из сплавов путем электролиза.
Также возможно восстановление щелочных металлов путем реакции с другими веществами. Например, калий может быть восстановлен из его оксида путем реакции с водородом. В результате образуется гидроксид калия и выделяется металлический калий.
Еще одним способом восстановления щелочных металлов является использование сильных восстановителей. Например, натрий может быть восстановлен из его оксида путем реакции с алюминием или кремнием. В результате образуется металлический натрий и оксид алюминия или кремния.
Использование щелочных металлов в промышленности

Щелочные металлы – это элементы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), которые имеют многочисленные применения в промышленности. Они обладают высокой химической реактивностью и электрохимическими свойствами, что делает их востребованными в разных областях производства.
Одним из основных применений щелочных металлов является их использование в аккумуляторах и батареях. Щелочные металлы, такие как литий и натрий, обладают высокими электрохимическими свойствами, что делает их идеальными для использования в современных литий-ионных аккумуляторах. Эти аккумуляторы широко используются в мобильных устройствах, электромобилях и других устройствах, требующих длительного времени работы и высокую емкость.
Щелочные металлы также применяются в металлургической промышленности. Например, натрий используется для получения алюминия из его оксида, что является одним из основных этапов промышленного производства этого металла. Калий используется в процессе получения удобрений, а рубидий и цезий – в производстве электронных компонентов и лазеров.
Кроме того, щелочные металлы находят применение в химической промышленности. Натрий и калий широко используются в качестве катализаторов и реагентов при синтезе органических соединений. Они также используются в процессе производства стекла и мыла.
Таким образом, использование щелочных металлов в промышленности является важным и неотъемлемым элементом современных технологий. Их уникальные химические и электрохимические свойства делают их особенно ценными в таких сферах, как энергетика, металлургия и химическая промышленность.
Преимущества использования щелочных металлов в энергетике
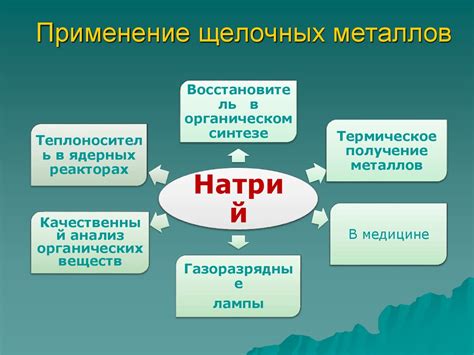
Щелочные металлы, такие как литий, натрий и калий, имеют ряд преимуществ, которые делают их важными компонентами в энергетической отрасли.
- Высокая энергетическая плотность: Щелочные металлы обладают высокой энергетической плотностью, что делает их эффективным источником энергии. Они могут образовывать стабильные химические соединения, выделяющие большое количество энергии при реакции.
- Большая степень доступности: Щелочные металлы являются широко распространенными и легко доступными материалами. Они находятся в обилии в земной коре и их запасы хорошо изучены.
- Низкая цена: Использование щелочных металлов в энергетике может быть экономически выгодным, поскольку они обладают низкой стоимостью. Это делает их привлекательными вариантом для промышленных и коммерческих приложений.
- Устойчивость к окружающей среде: В отличие от некоторых других источников энергии, щелочные металлы обладают низким уровнем загрязнения окружающей среды. Они не выделяют вредных веществ или выбросов, что делает их экологически безопасными и стабильными.
- Возможность многократного использования: Щелочные металлы могут быть продуктивно восстановлены и отрегенерированы после использования. Это снижает потребность в постоянной добыче и долгосрочно уменьшает нагрузку на природу и окружающую среду.
В целом, использование щелочных металлов в энергетике представляет значительные преимущества с точки зрения энергетической эффективности, доступности, экономической эффективности и устойчивости к окружающей среде.
Негативные последствия от неправильного использования щелочных металлов

Неправильное использование щелочных металлов может иметь серьезные негативные последствия для здоровья и окружающей среды. Во-первых, при неправильном хранении и утилизации щелочных металлов может произойти их неконтролируемое распространение в окружающую среду. Это может привести к загрязнению почвы, воды и воздуха, что негативно сказывается на живых организмах и экосистемах.
Во-вторых, щелочные металлы могут быть опасными при контакте с кожей, глазами или вдыхании. Некорректное обращение с ними может привести к ожогам, раздражению кожи и слизистых оболочек, а также проблемам с дыхательной системой. Поэтому очень важно соблюдать все меры предосторожности при работе с щелочными металлами и использовать защитное снаряжение.
Кроме того, неправильное использование щелочных металлов может привести к несчастным случаям и взрывам. Щелочные металлы реагируют с водой, и если не соблюдать правила безопасности, такую реакцию можно вывести из-под контроля. Это особенно опасно при работе на предприятиях, где используются большие объемы щелочных металлов.
Итак, неправильное использование щелочных металлов может вызвать загрязнение окружающей среды, причинить вред здоровью и привести к несчастным случаям. Поэтому обращение с этими веществами должно быть подкреплено достаточными знаниями о их свойствах и правилами безопасности. Качественная организация хранения, использования и утилизации щелочных металлов позволит минимизировать негативные последствия и обеспечить безопасность для людей и природы.
Перспективы развития и новые направления применения щелочных металлов

Щелочные металлы, такие как литий, натрий и калий, являются одними из наиболее распространенных и важных элементов в природе. Они имеют широкий спектр применений в различных отраслях промышленности, научных исследованиях и медицине.
Одной из перспективных областей развития в использовании щелочных металлов является энергетика. Литий, например, широко применяется в производстве литий-ионных аккумуляторов, которые используются в портативных электронных устройствах, электромобилях и даже стационарных энергетических хранилищах. Весьма актуальной темой является также разработка новых материалов на основе щелочных металлов для более эффективных и долговечных аккумуляторов.
Новые направления применения щелочных металлов также связаны с развитием технологий в области оптики и светотехники. Например, натрий применяется в производстве светофильтров и оптических стекол, а калий используется в создании светоизлучающих диодов и лазеров. Развитие этих технологий позволяет создавать новые источники света с улучшенными характеристиками и энергосберегающими свойствами.
Кроме того, щелочные металлы имеют широкое применение в фармацевтической и медицинской промышленности. Натрий и калий используются в качестве регуляторов водно-электролитного баланса в организме человека, а литий широко применяется в лечении психических расстройств, таких как биполярное расстройство и депрессия. Дальнейшее исследование и разработка новых препаратов на основе щелочных металлов может привести к появлению более эффективных и безопасных лекарственных препаратов.
Вопрос-ответ

Зачем нужно восстановительное взаимодействие щелочных металлов?
Восстановительное взаимодействие щелочных металлов важно для многих процессов в химии и промышленности. Оно позволяет реагировать с окислителями и переводить их в соответствующие оксиды или соли с уменьшением их окислительного состояния. Восстановительные реакции также широко используются в синтезе органических соединений и в процессах получения металлов из их руд.
Какие щелочные металлы могут вступать в восстановительное взаимодействие?
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), могут вступать в восстановительное взаимодействие. Эти элементы обладают высокой активностью и легко отдают свои валентные электроны, что делает их хорошими восстановителями.
Как протекает восстановительное взаимодействие щелочных металлов с окислителями?
Восстановительное взаимодействие щелочных металлов с окислителями протекает путем передачи электронов от металла к окислителю. В результате этой реакции, щелочный металл окисляется, а окислитель восстанавливается. Например, при реакции натрия с хлором, натрий отдает свой валентный электрон хлору, формируя ион натрия Na+ и хлоридный ион Cl-.
