Щелочные металлы – это группа элементов периодической таблицы, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили название «щелочные» из-за свойств образования оснований (щелочей) в реакциях с водой и простых соединений. Щелочные металлы являются элементами первой группы и имеют одну электронную оболочку.
Литий является самым легким из щелочных металлов и обладает наименьшей плотностью. Он имеет высокую реакционную способность и широко используется в производстве аккумуляторов. Натрий является одним из важных элементов для живых организмов, так как участвует в регулировании водно-солевого баланса. Калий играет важную роль в работе сердечно-сосудистой системы и нервной системы человека.
Рубидий и цезий характеризуются высокой реакционной способностью и обладают свойствами, применимыми в научных исследованиях и в производстве компонентов электронной техники. Франций является самым редким и радиоактивным элементом группы, его свойства малоизучены.
Щелочные металлы в естественной форме не встречаются из-за их высокой реакционной способности. Они характеризуются низкой плотностью, мягкостью и низкой температурой плавления. Щелочные металлы обладают высокой электропроводностью и хорошо растворимы в воде. Они играют важную роль в различных сферах человеческой деятельности, таких как медицина, промышленность и научные исследования.
Химические свойства щелочных металлов

Щелочные металлы - это первая группа периодической системы элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Химические свойства щелочных металлов связаны с их низкой ионизационной энергией и способностью образовывать одновалентные катионы.
Щелочные металлы обладают сильными основными свойствами и быстро реагируют с водой, кислородом и другими химическими веществами. Они активно взаимодействуют с водой, образуя щелочные растворы. Например, калий реагирует с водой с образованием гидроксида калия (калийной щелочи) и выделением водорода.
Большинство щелочных металлов образуют стабильные оксиды и гидроксиды, которые имеют важное применение в промышленности. Натрий и калий, например, используются в процессе производства мыла и стекла. Щелочные металлы также используются в батареях и аккумуляторах, так как они обладают способностью эффективно передавать ионы в реакциях окисления и восстановления.
Еще одной важной химической свойство щелочных металлов является их реакция с кислородом. При окислении щелочных металлов они образуют оксиды, которые при соприкосновении с водой превращаются в гидроксиды. Например, литий горит в воздухе, образуя литиевый оксид, а калий образует пероксид и гидроксид при реакции с кислородом.
Физические свойства щелочных металлов

Щелочные металлы представляют собой группу элементов, включающих литий, натрий, калий, рубидий, цезий и франций. Они отличаются от других металлов своими уникальными физическими свойствами.
Первое заметное физическое свойство щелочных металлов - это их низкая плотность. В силу своей низкой атомной массы и большого размера атома, они обладают небольшой массой при относительно большом объеме. Например, литий имеет плотность всего около 0,53 г/см³, что делает его менее плотным, чем большинство водных растворов и других металлических элементов.
Еще одним физическим свойством щелочных металлов является их низкая температура плавления. Все щелочные металлы плавятся при очень низких температурах, в диапазоне от 180 до 302 градусов Цельсия. Калий, например, плавится при температуре всего 63 градуса Цельсия, что делает его одним из самых низкотемпературных плавящихся металлов в мире.
Еще одно интересное физическое свойство щелочных металлов - их высокая электропроводность. Благодаря наличию свободных электронов в зоне проводимости, щелочные металлы обладают способностью проводить электрический ток очень хорошо. Они являются лучшими металлическими проводниками среди всех элементов периодической таблицы.
Также щелочные металлы обладают высокой реактивностью. Они очень химически активны и легко реагируют с воздухом, водой и другими веществами. Например, калий и рубидий могут вступать в реакцию с водой с выделением водорода, а натрий может гореть в контакте с воздухом. Это делает щелочные металлы опасными для обычного использования и требует специальных мер предосторожности при работе с ними.
Плотность и температура плавления щелочных металлов
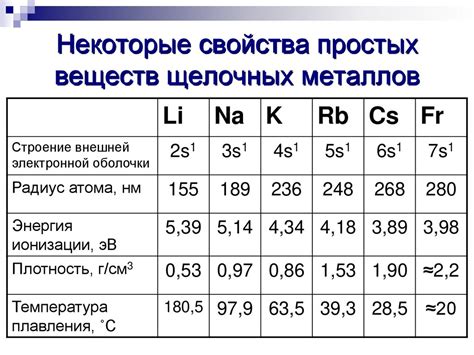
Плотность щелочных металлов, таких как литий, натрий, калий и др., составляет около 0,5-1,9 г/см³ в зависимости от конкретного металла. Это связано с их низкой атомной массой и большим радиусом атома, что позволяет атомам щелочных металлов плотно упаковываться в кристаллической решетке.
Что касается температуры плавления щелочных металлов, то она также невысока. Например, литий плавится при температуре около 180 °C, натрий – при 97,8 °C, а калий – при 63,5 °C. Это связано с тем, что щелочные металлы обладают слабыми межатомными связями и атомы легко смещаются друг относительно друга, обеспечивая текучесть металла.
Низкая температура плавления щелочных металлов позволяет использовать их в различных технических приложениях, например, в производстве аккумуляторных батарей или при создании сплавов с другими элементами. Однако, в силу их реакционной способности с воздухом и влагой, щелочные металлы должны храниться в специальных условиях, чтобы предотвратить их окисление и реакции с другими веществами.
Электропроводность щелочных металлов
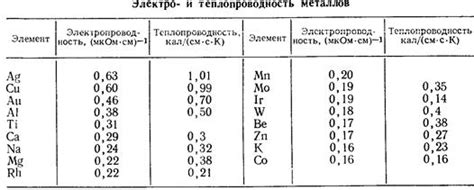
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, отличаются высокой электропроводностью. Это связано с особенностями их электронной структуры и присутствием свободных электронов.
В щелочных металлах, атомы образуют кристаллическую решетку, где положительно заряженные ионы металла окружены свободными электронами. Эти свободные электроны могут легко перемещаться по кристаллической решетке, создавая ток.
Электропроводность щелочных металлов обусловлена высокой подвижностью свободных электронов и их способностью передавать электрический заряд. Это свойство делает эти металлы хорошими проводниками электричества.
Помимо свободных электронов, щелочные металлы также обладают высокой ионной проводимостью. Ионы щелочных металлов могут двигаться в решетке кристалла, создавая электропроводность даже при отсутствии свободных электронов.
Важно отметить, что электропроводность щелочных металлов зависит от температуры. При низких температурах электропроводность снижается из-за уменьшения подвижности свободных электронов и ионов. Однако, при повышении температуры, электропроводность увеличивается из-за возрастания количества свободных электронов и ионов, которые могут передавать электрический заряд.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий и калий, имеют широкое применение в различных сферах промышленности.
1. Литий: Литий является одним из наиболее важных элементов в производстве аккумуляторов. Он используется в литий-ионных батареях, которые применяются в мобильных устройствах, электромобилях и даже космических аппаратах. Литий также находит применение в производстве стекла, керамики и легких сплавов.
2. Натрий: Натрий широко используется в химической промышленности для производства продуктов питания, фармацевтики и мыла. Натрий является необходимым компонентом при производстве пищевых добавок, таких как поваренная соль и содительные напитки. Он также применяется в производстве стекла и щелочи.
3. Калий: Калий является важным удобрением и применяется в сельском хозяйстве для повышения урожайности. Он используется в производстве удобрений, таких как калийные соли и калийный оксид. Калий также применяется в производстве стекла, мыла и щелочи.
Щелочные металлы имеют большое значение в различных отраслях экономики. Их использование способствует развитию инноваций и современных технологий, обеспечивая прогресс и улучшение качества жизни.
Использование щелочных металлов в производстве стекла

Щелочные металлы, такие как натрий, калий и литий, широко применяются в производстве стекла. Они не только улучшают качество стекла, но и позволяют достичь необходимой прозрачности и прочности изделий.
Одно из основных применений щелочных металлов в производстве стекла - это использование натрия в качестве стекломассы. Натрий способствует снижению температуры плавления и улучшает текучесть материала. Благодаря наличию натрия, стекломасса приобретает пластичность и легко поддается формированию.
Калий также имеет важное значение в процессе производства стекла. Он используется в качестве добавки к стекломассе для придания ей дополнительной прочности и устойчивости к термическим воздействиям. Калий позволяет улучшить структуру стекла, делая его более скрещенным и устойчивым к повреждениям.
Существует множество способов использования щелочных металлов в производстве стекла. Одним из них является использование реагентов на основе лития. Литий обладает высокими светопропускающими свойствами и способствует улучшению оптических характеристик стекла. Он применяется при производстве линз, оптических приборов, стеклопакетов.
Таким образом, использование щелочных металлов, таких как натрий, калий и литий, существенно влияет на качество и свойства стекла. Они позволяют достичь нужных характеристик стекла, таких как прозрачность, прочность, устойчивость к термическим воздействиям, что делает стекло одним из наиболее важных и универсальных материалов в современном производстве.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа химических элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической таблицы и обладают рядом общих характеристик, таких как низкая плотность, мягкость, низкая температура плавления и высокая реакционность с водой и воздухом.
Есть ли какие-либо риски или опасности, связанные с щелочными металлами?
Щелочные металлы могут быть опасными при неправильном обращении с ними. Они являются высоко реакционными с водой, что может привести к возникновению огня или взрыва. При работе с ними необходимо соблюдать все соответствующие меры предосторожности, такие как использование защитных очков и перчаток, а также проведение работы в хорошо проветриваемых помещениях или под вытяжкой.
