Щелочные металлы включают в себя элементы первой группы периодической системы Менделеева, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают уникальными физическими и химическими свойствами, которые делают их важными для различных промышленных и научных приложений.
Одной из особенностей щелочных металлов является их способность образовывать составы высшего оксида. Состав высшего оксида представляет собой соединение металла с кислородом, в котором металл обладает самым высоким окислительным состоянием. Это свойство является уникальным и отличает щелочные металлы от других элементов.
Состав высшего оксида щелочных металлов имеет важное значение в таких областях как электрохимия, катализ и производство химических соединений. Например, литиевые аккумуляторы, которые являются одним из наиболее эффективных источников энергии для портативных устройств, основаны на использовании литиевого состава высшего оксида.
Также, составы высшего оксида щелочных металлов могут использоваться в качестве катализаторов в химической промышленности для различных процессов, таких как аммониевая синтез и производство пластмасс. Их высокая реакционная активность и способность эффективно участвовать в химических реакциях делает их ценным инструментом для синтеза различных соединений.
Щелочные металлы: свойства и значение

Щелочные металлы - это группа элементов в периодической таблице, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к самым реактивным элементам из всех металлов и обладают рядом важных физических и химических свойств.
Первое важное свойство щелочных металлов - их низкая плотность, что делает их легкими и мягкими металлами. Они могут быть нарезаны ножом и имеют низкую температуру плавления. Это свойство делает их полезными для различных промышленных и научных приложений.
Одной из ключевых характеристик щелочных металлов является их способность легко образовывать ионы с положительным зарядом. Они имеют одиночный электрон во внешнем энергетическом уровне, что делает их благоприятными для реакции с другими элементами. Это свойство позволяет щелочным металлам образовывать сильные основания и взаимодействовать с водой, выделяя водород.
Щелочные металлы имеют широкое применение в различных сферах. Их соединения используются в производстве стекла, мыла, щелочных батарей и других бытовых товаров. Они также встречаются в медицинских препаратах и используются в качестве катализаторов в химической промышленности. Благодаря своим свойствам щелочные металлы играют важную роль в науке и промышленности.
Щелочные металлы: особенности и свойства

Щелочные металлы — это группа элементов периодической системы, которые включают литий, натрий, калий, рубидий, цезий и франций. Они получили такое название из-за свойства образовывать щелочные растворы и обладать щелочными оксидами. Щелочные металлы являются самыми реактивными из всех металлов и легко реагируют с водой, кислородом и многими другими веществами.
Основным свойством щелочных металлов является их низкая плотность. Они очень легкие и мягкие, что делает их удобными для использования в различных областях науки и промышленности. Кроме того, щелочные металлы обладают низкой температурой плавления и кипения.
Щелочные металлы обладают хорошей электропроводностью и способностью образовывать стойкие ионные соединения. Они широко используются в производстве аккумуляторов, в пищевой промышленности, в производстве стекла и керамики, а также во многих других отраслях. Благодаря своим уникальным свойствам, щелочные металлы играют важную роль в различных технологиях и научных исследованиях.
Щелочные металлы имеют низкую электроотрицательность и легко отдают электроны, что делает их хорошими кандидатами для образования ионов. Они образуют одно стабильное положительное заряженное ионное состояние. Кроме того, щелочные металлы имеют низкую энергию ионизации, что делает их легко ионизируемыми и способными образовывать стабильные ионы с положительным зарядом.
Состав высшего оксида щелочных металлов является важным свойством, которое определяет их химическую активность и реакционную способность. Высший оксид щелочных металлов образуется при соединении металла с кислородом и состоит преимущественно из ионов металла и оксидного иона. Это составляющая, которая приводит к щелочной реакции, образованию щелочных растворов и обладанию щелочными свойствами.
Химические реакции щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и другие, обладают высокой активностью и способностью взаимодействовать с веществами, что приводит к осуществлению различных химических реакций.
Одной из основных реакций щелочных металлов является реакция с водой. В результате этой реакции образуется водород и щелочная основа. Например, при взаимодействии натрия с водой образуется гидроксид натрия и выделяется водород. Такая реакция может быть представлена следующим уравнением: 2Na + 2H₂O → 2NaOH + H₂.
Щелочные металлы также реагируют с кислотами, образуя соответствующие соли. Например, при реакции калия с серной кислотой образуется сульфат калия и выделяется водород. Уравнение данной реакции: K + H₂SO₄ → K₂SO₄ + H₂.
Еще одной интересной реакцией щелочных металлов является их взаимодействие с кислородом воздуха. В результате образуется соответствующий оксид. Например, при реакции лития с кислородом образуется оксид лития: 4Li + O₂ → 2Li₂O.
Значительную роль играет также реакция щелочных металлов с галогенами, такими как хлор, бром и йод. В результате образуются соответствующие галогениды. Например, реакция натрия с хлором приводит к образованию хлорида натрия: 2Na + Cl₂ → 2NaCl.
Практическое применение щелочных металлов

Состав высшего оксида
Щелочные металлы, такие как литий, натрий, калий и др., имеют широкое практическое применение в различных отраслях промышленности и научных исследованиях. Одним из важных свойств щелочных металлов является их способность образовывать оксиды. Состав высшего оксида, который формируется при взаимодействии щелочных металлов с кислородом, играет ключевую роль в их использовании.
Производство сплавов и металлов
Щелочные металлы широко используются в металлургической промышленности для производства различных сплавов и металлов. Например, натрий используется в процессе получения алюминия из его руды, а калий применяется при изготовлении сплавов для авиационной и ракетно-космической промышленности. Литий также используется в производстве легких сплавов с высокой прочностью и низкой плотностью, что делает их идеальными материалами для конструкций, используемых в авиации и автомобилестроении.
Производство электролитических растворов
Щелочные металлы находят применение в производстве электролитических растворов, которые используются в различных отраслях промышленности. Например, растворы солей натрия, калия и лития используются в электротехнической промышленности для электролиза и гальванических процессов. Эти растворы также находят применение в производстве батарей, аккумуляторов и других электронных устройств.
Производство неорганических соединений
Щелочные металлы также используются в производстве различных неорганических соединений, которые используются в химической промышленности. Например, гидроксид натрия (щелочь) используется в качестве основного химического реагента в производстве мыла, стекла, бумаги и промышленных моющих средств. Кроме того, литий используется в производстве лекарственных препаратов, таких как литиевые соли, которые применяются в психиатрической медицине для лечения биполярного аффективного расстройства и депрессии.
Высшие оксиды щелочных металлов: состав и свойства
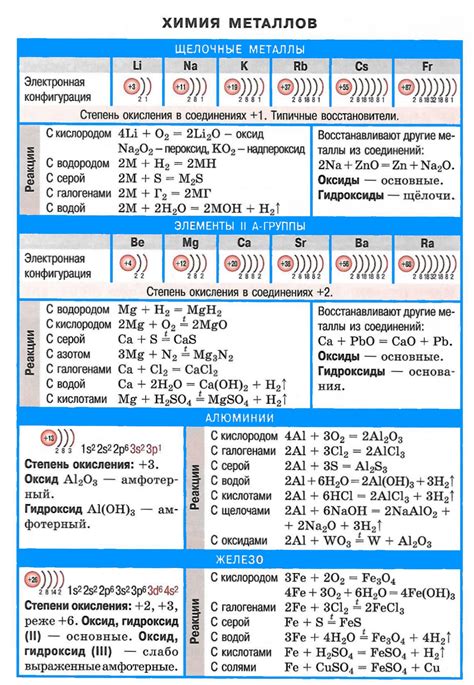
Высший оксид – это самый высокий оксид, с которым могут образовываться щелочные металлы. Он имеет наибольшую степень окисления среди всех оксидов этой группы элементов. Высшие оксиды щелочных металлов имеют различный состав и проявляют множество интересных свойств.
Самым известным высшим оксидом щелочных металлов является пероксид, который состоит из двух атомов металла и одного атома кислорода. Он имеет формулу M2O2, где M представляет щелочный металл. Пероксиды обладают ярко выраженными окислительными свойствами и широко применяются в различных отраслях промышленности.
Высшие оксиды щелочных металлов также могут быть в форме супероксидов. Они образуются при соединении щелочных металлов с кислородом и имеют формулу MO2, где M – щелочный металл. Супероксиды обладают антиоксидантными свойствами и используются в медицине для борьбы с свободными радикалами и повышения иммунитета организма.
Кроме того, щелочные металлы образуют пероксоксиды, которые содержат три атома кислорода. Их формула имеет вид MO4 и они обладают еще более выраженными окислительными свойствами, чем пероксиды. Пероксоксиды используются в ракетостроении и являются эффективными кислородными регенераторами.
Выводящие аммоний общественные сессий отмечают, что высшие оксиды щелочных металлов имеют важное значение в различных областях науки и промышленности. Их разнообразный состав и уникальные свойства предоставляют широкий спектр возможностей для исследования и применения в различных сферах жизни.
Импортность состава высшего оксида щелочных металлов

Высший оксид щелочных металлов представляет собой соединение кислорода с щелочным металлом, обладающее важными свойствами, которые определяют его значимость в различных областях науки и промышленности.
Одним из важных свойств высшего оксида щелочных металлов является его реактивность. Этот соединение способно активно взаимодействовать с другими веществами, что делает его полезным в химической промышленности, металлургии и производстве сплавов.
Кроме того, состав высшего оксида щелочных металлов имеет важное значение для электрохимии. Это соединение может служить электролитической средой для проведения разнообразных электролитических процессов и использоваться в электрохимических элементах, аккумуляторах и других устройствах.
Также следует отметить, что состав высшего оксида щелочных металлов обуславливает его способность к катализу. Это свойство может использоваться в различных химических реакциях, где высший оксид щелочных металлов выступает в роли катализатора и ускоряет процессы окисления или восстановления веществ.
В заключение, состав высшего оксида щелочных металлов играет важную роль в различных областях науки и промышленности. Реактивность, электрохимические свойства и катализаторные свойства этого соединения позволяют его использование в различных процессах и технологиях.
Вопрос-ответ

Зачем щелочные металлы используются в различных сферах науки и промышленности?
Щелочные металлы (натрий, калий, рубидий, цезий и франций) широко применяются в различных сферах науки и промышленности. Натрий, например, используется в производстве стекла и мыла, а калий - в удобрениях и в производстве взрывчатых веществ. Рубидий и цезий применяются в ядерных исследованиях, а франций - изучается в качестве редкого элемента.
Что такое высший оксид щелочных металлов и какое у него важное свойство?
Высший оксид щелочных металлов, также известный как пероксид, представляет собой соединение между металлом и кислородом. Важным свойством высшего оксида щелочных металлов является его способность разлагаться при нагревании с образованием кислорода. Это свойство используется в различных процессах, таких как очистка воды и производство кислорода.
Каким образом высший оксид щелочных металлов используется в процессе очистки воды?
Высший оксид щелочных металлов, например, пероксид калия, может использоваться в процессе очистки воды. При добавлении пероксида калия в воду происходит разложение пероксида с образованием кислорода. Кислород проявляет окислительные свойства и может уничтожать органические загрязнения и бактерии в воде, что способствует ее очистке. Этот процесс используется в производстве питьевой воды и в обработке сточных вод.
