Щелочные металлы, включая литий, натрий, калий и другие элементы, обладают способностью образовывать летучие водородные соединения. Это явление, называемое водородной активностью, происходит из-за химической реакции металла с водой или другими веществами, содержащими водород.
Взаимодействие воды с щелочными металлами приводит к образованию характерных гидроксидов и выделению водородного газа. Например, реакцию лития с водой можно представить следующим образом:
2Li + 2H2O → 2LiOH + H2
Подобные реакции могут происходить с разными соединениями водорода, например, с аммиаком (NH3) или гидридами. Это особенно значимо, так как водород является чрезвычайно важным и перспективным веществом для различных отраслей промышленности и энергетики.
Другим примером образования водородных соединений щелочных металлов является реакция с алканами, такими как метан (CH4). При нагревании метана с натрием, происходит реакция с образованием натриевого гидрида и выделением метана:
2Na + CH4 → 2NaH + C
Исследование процессов образования летучих водородных соединений щелочных металлов имеет большое практическое значение и является активной областью научных исследований.
Роль водородных соединений щелочных металлов

Водородные соединения щелочных металлов играют важную роль в различных областях науки и техники. Они обладают уникальными свойствами, которые позволяют использовать их в разнообразных процессах и при создании новых материалов.
Водородные соединения щелочных металлов имеют высокую проточность и летучесть. Это означает, что они легко выделяются в газообразной форме при нагреве или разложении соответствующих соединений. Эти свойства делают их прекрасными кандидатами для использования в различных химических процессах, например, в производстве ракетного топлива или водородных батарей.
Водородные соединения щелочных металлов также обладают высокой абсорбционной способностью. Они способны активно взаимодействовать с другими веществами, адсорбируя их на своей поверхности. Благодаря этому свойству они используются в различных катализаторах, а также в процессе очистки и сепарации различных газов и жидкостей.
Водородные соединения щелочных металлов являются важными компонентами электролитов. Благодаря своей расплавленной или газообразной форме они способны проводить электрический ток. Это делает их незаменимыми для различных электрохимических процессов, включая производство металлов и электрохимические реакции в батареях и аккумуляторах.
Таким образом, водородные соединения щелочных металлов играют важную роль в различных областях, начиная от энергетики и ракетостроения и заканчивая химической и электрохимической промышленностью. Их уникальные свойства делают их значимыми материалами, способными улучшить и оптимизировать множество процессов и технологий.
Химические свойства летучих соединений

Летучие соединения, включающие летучие водородные соединения щелочных металлов, обладают рядом уникальных химических свойств, которые делают их полезными в различных областях науки и промышленности.
Первое значимое свойство летучих соединений – их возможность образовывать жидкие и газообразные состояния при комнатной температуре и атмосферном давлении. Это позволяет использовать их для дезинфекции и стерилизации помещений, а также в процессах синтеза органических соединений.
Второе важное свойство летучих соединений – они обладают растворяющей способностью. Благодаря этому они могут использоваться для очистки металлов от примесей, а также для процессов экстракции и извлечения ценных соединений из руд.
Еще одно значимое свойство летучих соединений – их реакционная активность. Они являются сильными водородными донорами и могут участвовать во многих химических реакциях. Это делает их полезными в качестве катализаторов, а также в синтезе различных соединений, в том числе фармацевтических препаратов и полимеров.
Следует отметить, что химические свойства летучих щелочных соединений зависят от их структуры и электронной конфигурации. Они также могут образовывать разнообразные соединения с другими элементами, что позволяет расширить их применение в различных областях науки и технологий.
Реакции образования водородных соединений
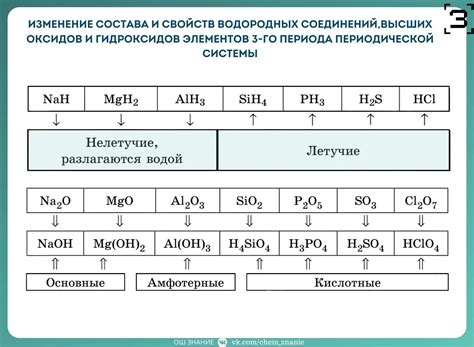
Образование водородных соединений щелочных металлов является одним из важных процессов, которые происходят в ходе их взаимодействия с водой или кислородом воздуха. В результате реакций образуются водородные газы, которые могут быть использованы в различных областях, например, в производстве водородной энергии или в качестве топлива.
Реакции образования водородных соединений касаются как простых металлов, так и их соединений с кислородом или другими элементами. Например, щелочные металлы, такие как литий, натрий и калий, могут реагировать с водой, образуя щелочные гидроксиды и водород. Реакции протекают в соответствии с химическими уравнениями:
- 2Li + 2H2O → 2LiOH + H2
- 2Na + 2H2O → 2NaOH + H2
- 2K + 2H2O → 2KOH + H2
В процессе образования водородных соединений может наблюдаться выделение газа и образование пены или пузырей. Эти реакции осуществляются в водной среде и активно используются в химическом образовании и исследованиях.
Технологии получения летучих водородных соединений

1. Гидрогенизация
Одним из основных методов получения летучих водородных соединений является гидрогенизация. Этот процесс заключается в реакции между щелочными металлами и водородом. Для этого удаление с поверхности металла оксидной пленки и нагревание смеси щелочного металла с водородом в вакууме или при повышенных давлениях. После реакции полученное летучее водородное соединение можно собрать и использовать в дальнейших процессах.
2. Пиролиз
Еще одним способом получения летучих водородных соединений является пиролиз. Этот процесс основан на нагреве щелочных металлов в атмосфере водорода при высокой температуре. При этом происходит расщепление молекул металла и образование летучих соединений.
3. Реакция с водным паром
Другой способ получения летучих водородных соединений - это реакция щелочных металлов с водяным паром. При этом щелочный металл реагирует с водяными молекулами, образуя летучие водородные соединения и гидроксиды. Данная реакция может протекать при различных условиях - от нагревания смеси до использования катализаторов.
4. Электролиз
Также с помощью электролиза можно получить летучие водородные соединения. В этом случае используется электролизер, в котором проводится разложение воды на водород и кислород. Затем летучий водород можно собрать и использовать в нужных целях.
Применение соединений летучих щелочных металлов в различных отраслях промышленности
Соединения летучих водородных соединений щелочных металлов, таких как гидриды натрия и калия, находят широкое применение в различных отраслях промышленности.
В химической промышленности эти соединения используются в качестве водородных носителей, а также промежуточных продуктов при получении различных химических соединений, включая аммиак, спирт и лаки. Применение гидридов щелочных металлов позволяет упростить и ускорить процесс получения различных химических веществ.
В энергетической отрасли соединения летучих щелочных металлов используются в качестве источников водорода для питания топливных элементов, что позволяет получить электрическую энергию с высоким КПД и уменьшить выбросы вредных веществ в окружающую среду.
Соединения летучих щелочных металлов также находят применение в электронике и полупроводниковой промышленности. Например, гидриды натрия используются при получении полупроводниковых материалов для создания электронных компонентов, таких как транзисторы и светодиоды. Это связано с возможностью контролировать электрические свойства материалов путем изменения содержания гидридов в структуре материала.
В области пищевой промышленности соединения летучих щелочных металлов используются как пищевые добавки и регуляторы кислотности. Они применяются для улучшения вкусовых качеств и сохранения продуктов питания, а также для регулирования pH-значения пищевых продуктов.
Вопрос-ответ

Что такое летучие водородные соединения щелочных металлов?
Летучие водородные соединения щелочных металлов - это химические соединения, состоящие из щелочного металла (например, лития, натрия, калия) и водорода. Они обладают высокой летучестью, что означает, что они легко испаряются и образуют газообразное состояние при обычных условиях. Эти соединения имеют важное применение в различных областях, таких как электрохимия, катализ и энергетика.
Как образуются летучие водородные соединения щелочных металлов?
Летучие водородные соединения щелочных металлов образуются в результате реакции между металлом и водородом. В обычных условиях, щелочные металлы имеют свойство активно взаимодействовать с водородом, освобождая энергию и образуя соединения. Например, литий может образовывать соединения LiH, натрий - NaH, калий - KH. Эти соединения являются летучими, то есть они легко испаряются и могут образовывать газообразное состояние.
Каковы основные применения летучих водородных соединений щелочных металлов?
Летучие водородные соединения щелочных металлов имеют широкий спектр применений. Они используются в электрохимии, катализе и энергетике. Например, эти соединения могут использоваться в качестве эффективных катализаторов для многих химических реакций. Они также могут служить источником водорода при наличии надлежащих реакционных условий. Это особенно важно в области энергетики, где водород может быть использован как чистый источник энергии.
Какие свойства делают летучие водородные соединения щелочных металлов особенными?
Летучие водородные соединения щелочных металлов обладают несколькими особыми свойствами. Во-первых, они обладают высокой летучестью, что означает, что они легко испаряются при обычных условиях и образуют газообразное состояние. Во-вторых, они являются химически активными и могут легко взаимодействовать с другими веществами. Эти соединения также обладают высокой энергией связи, что делает их полезными в качестве источника водорода.
