Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и рубидий (Rb), обладают особенностями в своей химической активности. Они находятся в первой группе периодической системы элементов и являются самыми активными металлами. В химических соединениях эти металлы образуют ионную связь, и часто находятся в окислительном состоянии с ионной связью и степенью окисления 1.
Степень окисления обозначает количество электронов, которые металл отдает при образовании ионов. В случае щелочных металлов, они отдают один электрон и образуют положительно заряженные ионы. Эти ионы являются сильными окислителями и могут вступать в реакции с другими веществами, перенося электроны на них, что приводит к их окислению.
Щелочные металлы в окислительном состоянии с ионной связью играют важную роль в многих химических реакциях и процессах. Они используются в производстве сплавов, стекла, щелочей, лекарственных препаратов и других продуктов. Кроме того, эти металлы имеют широкий спектр применений в батареях, солнечных батареях, ядерной энергетике и других отраслях науки и техники.
Химические свойства щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они характеризуются высокой активностью и образуют ионы с положительным зарядом, обладающие окислительными свойствами. Степень окисления для ионов щелочных металлов равна 1.
Щелочные металлы реагируют с водой, при этом образуется гидроксид металла и выделяется водород. Например, реакция натрия с водой выглядит следующим образом: 2Na + 2H2O → 2NaOH + H2. При этом образуется сильная щелочь – гидроксид натрия.
Щелочные металлы также реагируют с кислотами, образуя соль и выделяяся водород. Например, реакция калия с соляной кислотой: 2K + 2HCl → 2KCl + H2. Также щелочные металлы могут образовывать соли с другими соединениями, например, сульфаты или нитраты.
Щелочные металлы обладают высокой электропроводностью и используются в производстве батарей, взрывчатых веществ, стекловидных материалов и других промышленных продуктах. Они также широко применяются в медицине и сельском хозяйстве. Важной характеристикой щелочных металлов является их способность к образованию сплавов с другими металлами, что делает их незаменимыми в металлургической и строительной отраслях.
В заключение, химические свойства щелочных металлов определяют их уникальные возможности и широкий спектр применения в различных отраслях науки и промышленности.
Окислительное состояние и ионная связь
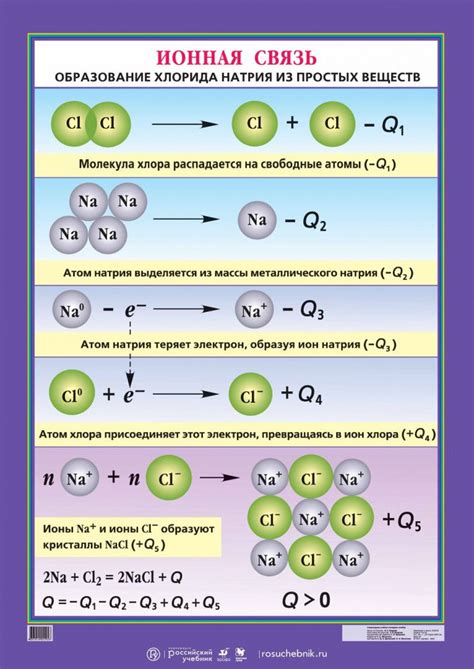
Окислительное состояние – это степень окисления атома в химическом соединении, выраженная числом и обозначающая потерю или приобретение электронов. Окислительное состояние бывает положительным или отрицательным, в зависимости от направления переноса электронов, и определяет роль атома в химической реакции.
Щелочные металлы – это элементы первой группы периодической системы, такие как литий, натрий, калий и др. В окислительном состоянии с ионной связью ион металла образует положительный ион (катион) со степенью окисления +1, теряя один электрон. Это обусловлено его низкой электроотрицательностью и способностью легко отдавать электроны.
Ионная связь – это связь, образующаяся между ионами разного знака, привлекающимися друг к другу в результате электростатического притяжения. Ионная связь характерна для веществ, содержащих ионы металлов и неметаллов, и обладает высокой прочностью и твердостью. Щелочные металлы, находясь в окислительном состоянии с ионной связью, образуют с неметаллами такие химические соединения, как щелочные гидроксиды, карбонаты и нитраты.
Окислительное состояние и ионная связь щелочных металлов с соответствующими неметаллами определяют их важность в различных процессах, включая образование солей, участие в реакциях окисления-восстановления и регулирование pH. Кроме того, щелочные металлы в окислительном состоянии с ионной связью часто используются в промышленности, медицине и электротехнике.
Степень окисления 1

Степень окисления 1 является одной из основных степеней окисления, в которой находятся некоторые щелочные металлы, такие как литий, натрий, калий и рубидий. В данной степени окисления атомы этих металлов теряют один электрон, что позволяет им образовывать положительные ионы с зарядом +1.
Щелочные металлы в окислительном состоянии с ионной связью находятся на крайней левой стороне периодической таблицы Менделеева. Это означает, что они имеют большую схильность отдавать электроны и образовывать положительные ионы.
Степень окисления 1 является характерной особенностью щелочных металлов и обусловлена их электронной конфигурацией. Атомы этих металлов имеют один валентный электрон, находящийся на наибольшем расстоянии от ядра. В процессе окисления атомы теряют этот валентный электрон и образуют однозарядные катионы.
Важно отметить, что степень окисления 1 щелочных металлов обусловлена их химической активностью. Эти металлы очень реакционны и легко вступают во взаимодействие с другими элементами. Например, литий может образовывать соединения с кислородом, образуя перекиси, а натрий может реагировать с водой, образуя щелочные растворы.
В заключение, степень окисления 1 щелочных металлов играет важную роль в их химических свойствах. Она определяет возможность образования положительных ионов с зарядом +1 и способность вступать в реакции с другими веществами. Изучение этой степени окисления позволяет лучше понять химическое поведение щелочных металлов и их влияние на окружающую среду.
Важность щелочных металлов в технологии

Щелочные металлы играют важную роль в современной технологии и промышленности. Они характеризуются наличием единственного электрона в внешней оболочке и высокой активностью, что делает их незаменимыми при производстве различных материалов и химических соединений.
Одним из основных применений щелочных металлов является производство щелочи, такой как гидроксид натрия и гидроксид калия. Эти вещества широко применяются в различных отраслях промышленности, включая производство стекла, мыла, моющих средств и многих других продуктов.
Окислительные свойства щелочных металлов приводят к их использованию в производстве аккумуляторных батарей. Они являются важной составляющей электродов и обеспечивают электролитические реакции, необходимые для хранения и высвобождения энергии.
Кроме того, щелочные металлы применяются в качестве катализаторов и промежуточных реагентов в различных органических синтезах. Они способны активировать химические связи и ускорять реакции, что является важным в процессе производства фармацевтических препаратов и других химических соединений.
Обширное использование щелочных металлов связано также с их способностью образовывать стабильные соединения с кислородом, что позволяет им служить материалами для создания легких и прочных конструкций, например, в авиационной и космической промышленности.
В целом, щелочные металлы являются неотъемлемой частью современных технологий и промышленности, обеспечивая широкий спектр возможностей для создания новых материалов, препаратов и технологических процессов.
Применение щелочных металлов в окислительном состоянии с ионной связью и степенью окисления 1 в производстве

Калий. Калий является одним из наиболее используемых щелочных металлов в производстве. Он широко применяется в качестве удобрений в сельском хозяйстве, помогая улучшить урожайность и качество различных культурных растений. Калий также используется в производстве стекла, мыла, ионных батарей и других продуктов, требующих щелочной среды для своего процесса изготовления.
Натрий. Натрий является еще одним широко используемым щелочным металлом в производстве. Он находит применение в производстве хлора и щелочей, которые используются в химической промышленности. Натрий также находит применение в производстве стекла, мыла, отбеливателей и других химических препаратов. Кроме того, натрий играет важную роль в производстве алюминия и металлов на основе лития.
Литий. Литий применяется в производстве аккумуляторов, таких как литий-ионные и литий-полимерные аккумуляторы, которые широко используются в портативных электронных устройствах, электромобилях и других технологиях. Литий также используется в производстве сплавов с целью повышения их прочности и легкости. Кроме того, литий используется в лечебных препаратах для лечения психических расстройств, таких как биполярное расстройство и депрессия.
Таким образом, щелочные металлы в окислительном состоянии с ионной связью и степенью окисления 1 играют важную роль в различных отраслях производства, обеспечивая необходимые химические свойства и функциональность различных продуктов и материалов.
Электронные устройства

Электронные устройства – это современные технологические инновации, которые используются во множестве сфер нашей жизни. Они состоят из различных компонентов, таких как микропроцессоры, полупроводниковые элементы и другие электронные детали.
Самые распространенные электронные устройства – это смартфоны, планшеты, компьютеры и ноутбуки. Они позволяют нам быть постоянно связанными с миром, обмениваться информацией и получать различные сервисы. Благодаря электронным устройствам мы можем выполнять множество задач, от общения с людьми до работы с данными и видеозаписями.
Важным аспектом развития электронных устройств является повышение их производительности и функциональности. Это достигается путем создания более мощных процессоров, увеличения объема памяти, улучшения экранов и увеличения емкости аккумуляторов. Благодаря этому электронные устройства становятся все более удобными и эффективными в использовании.
Кроме того, электронные устройства также играют важную роль в сфере развлечений. Мы можем смотреть фильмы, слушать музыку, читать книги и играть в игры, используя специально разработанные для этого программы и платформы. Благодаря электронным устройствам развлекательная индустрия становится доступной для широкой аудитории и предлагает множество разнообразных возможностей.
В целом, электронные устройства стали неотъемлемой частью современной жизни. Они упрощают и улучшают нашу повседневную деятельность, предлагают больше возможностей и помогают нам быть связанными с внешним миром. С ростом технологий можно ожидать еще большего развития электронных устройств и появления новых инноваций, которые изменят нашу жизнь еще сильнее.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это элементы химической группы 1 периодической системы Менделеева, включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к самым активным металлам и легко образуют ионные соединения сотрицательно заряженными ионами по окончании бразольной с рядом.
В чем заключается свойство щелочных металлов быть в окислительном состоянии?
Окислительное состояние металлов характеризуется тем, насколько они готовы отдавать электроны. Щелочные металлы имеют стремление отдавать один электрон, чтобы достичь электронной конфигурации благородного газа, и образовывать положительно заряженные ионы. Таким образом, они могут быть в окислительном состоянии, так как готовы окислять другие элементы, получая при этом дополнительный отрицательный заряд.
Какие ионные связи образуются с участием щелочных металлов?
Щелочные металлы образуют ионные связи с отрицательно заряженными атомами других элементов. Как уже было сказано, они готовы отдавать свой электрон, чтобы образовать положительно заряженные ионы. Эти ионы притягиваются к атомам с отрицательным зарядом, создавая кристаллическую решетку ионно-соединенного вещества.
Какова степень окисления щелочных металлов в ионных соединениях?
Степень окисления щелочных металлов в ионных соединениях составляет +1. Это связано с тем, что они отдают один электрон и образуют положительные ионы с однозначным зарядом. Литий (Li) и натрий (Na) имеют внешнюю оболочку с одним электроном, который достаточно легко отдают. Калий (K), рубидий (Rb), цезий (Cs) и франций (Fr) имеют внешнюю оболочку с одним электроном, который слабо связан и может быть легко отдан.
