Реактивность щелочных металлов при взаимодействии с кислотами является одной из основных характеристик этих элементов. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой активностью и способностью легко реагировать с кислотными соединениями.
Взаимодействие щелочных металлов с кислотами приводит к образованию солей и выделению водорода. Это связано с тем, что щелочные металлы имеют слабую электроотрицательность и легко отдают свой электрон, образуя положительно заряженный ион. Атомы кислорода в молекуле кислоты притягивают эти электроны, что приводит к образованию соли.
При взаимодействии щелочных металлов с сильными кислотами, такими как серная или азотная, реакция проходит более интенсивно и может сопровождаться выделением большого количества тепла и пены. Слабые кислоты, такие как уксусная или лимонная, образуют меньшее количество пены и обычно не сопровождаются значительным выделением тепла.
Реактивность щелочных металлов при взаимодействии с кислотами играет важную роль в различных процессах и применяется в таких областях, как производство солей, очистка от отработанных или загрязненных кислот, а также в химической аналитике для определения концентрации кислотных соединений.
Изучение реактивности щелочных металлов при взаимодействии с кислотами является важным аспектом химии и способствует развитию научных знаний в области химических превращений и реакций.
Реактивность щелочных металлов и их взаимодействие с кислотами

Щелочные металлы – это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой реактивностью благодаря своей низкой ионизационной энергии.
Реакция между щелочными металлами и кислотами является типичным примером реакции образования соли и выделения водорода (H2). Щелочные металлы являются сильными электронными донорами, что способствует протеканию реакции с кислотами.
Экспериментальные данные показывают, что реактивность щелочных металлов возрастает по порядку: Fr
При взаимодействии щелочных металлов с кислотами образуется соль и выделяется водород, который можно обнаружить появлением пузырьков или характерным шипящим звуком. Реакция протекает быстро и сильно выделяет тепло, что свидетельствует о высокой реактивности щелочных металлов.
Реакция щелочных металлов с различными кислотами может протекать с разной интенсивностью. Например, соляная кислота (HCl) более реактивна с щелочными металлами, чем уксусная кислота (CH3COOH). Однако, некоторые кислоты, такие как серная (H2SO4) или азотная (HNO3) кислоты, могут вызывать нежелательные реакции с щелочными металлами, такие как окисление металла или образование взрывоопасных соединений.
В целом, реактивность щелочных металлов и их взаимодействие с кислотами являются важным аспектом физической и химической науки. Эти реакции широко используются в лабораторных исследованиях, промышленности и повседневной жизни, и имеют большое значение для понимания основных принципов химии и реактивности веществ.
Свойства щелочных металлов и их группы в периодической системе
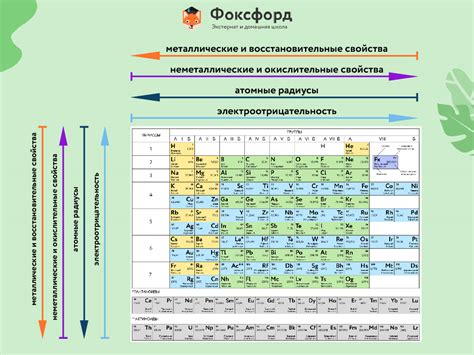
Щелочные металлы - первая группа элементов в периодической системе, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У всех щелочных металлов есть общие свойства, такие как низкая плотность, низкая температура плавления и кипения, их химическая реактивность возрастает от лития к францию.
Вода и кислород являются самыми важными веществами, с которыми щелочные металлы реагируют. При контакте с водой они образуют щелочные гидроксиды и выделяются водород. Эта реакция с водой протекает очень быстро и сильно, особенно с металлами ниже в группе, такими как натрий, калий и цезий.
Одно из самых интересных свойств щелочных металлов - способность образования сплавов с другими металлами. Это связано с тем, что у них очень низкая энергия ионизации, что позволяет им легко отдавать электроны и образовывать положительные ионы. Их реактивность также приводит к образованию солей и соединений с различными кислотами.
Стоит отметить, что у франция недостаток экспериментальных данных, поскольку она очень редкая и радиоактивная. Большинство данных о ней основаны на теоретических расчетах и моделях.
Таким образом, свойства щелочных металлов и их группы в периодической системе объединяют их высокую реактивность, способность к образованию соединений с кислотами и взаимодействию с водой и кислородом.
Щелочные металлы как активные элементы в химических реакциях

Щелочные металлы – это металлы первой группы периодической системы элементов – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реакционной способностью и считаются одними из самых активных элементов в химических реакциях. При взаимодействии с кислотами они проявляют особую реактивность и способны порождать различные продукты.
Взаимодействие щелочных металлов с кислотами приводит к образованию солей и выделению водорода. Главным продуктом реакции является соль, в которой металл ионизируется и образует положительный ион. Это связано с тем, что щелочные металлы обладают всего одним электроном во внешней оболочке и с легкостью отдают его при реакции. Водород выделяется благодаря реакции кислорода воды с активным металлом.
Реактивность щелочных металлов взаимодействии с кислотами возрастает при движении по периоду от лития к францию. Это связано с увеличением атомного радиуса и уменьшением энергии ионизации. Литий, обладающий наименьшим атомным радиусом, является наиболее реакционноспособным элементом из группы. Калий и цезий, имеющие большой атомный радиус, также проявляют высокую реакционность, но несколько ниже, чем литий.
Взаимодействие щелочных металлов с различными типами кислот

Щелочные металлы - это элементы первой группы периодической системы, которые в реакции с кислотами проявляют высокую активность. При этом, взаимодействие щелочных металлов с различными типами кислот может происходить по-разному.
Сильные неоксидные кислоты, например, соляная кислота (HCl), азотная кислота (HNO3) или серная кислота (H2SO4), реагируют с щелочными металлами со значительным выделением тепла и образованием солей. При этом образовавшаяся соль водорода может раствориться в воде и образовать кислотное окружение.
Некоторые щелочные металлы, например, натрий (Na) или калий (K), могут прореагировать даже с умеренно активными кислотами, такими как уксусная кислота (CH3COOH). В этом случае может происходить обмен ионами между щелочным металлом и кислотой, что приводит к образованию солей и выделению водорода.
Реакция между щелочными металлами и слабыми оксидными кислотами, например, угольной кислотой (H2CO3) или фосфорной кислотой (H3PO4), может протекать медленнее, так как образующиеся соли малорастворимы в воде. В этом случае реакция может происходить с образованием осадка соли.
В заключение, взаимодействие щелочных металлов с различными типами кислот может протекать с выделением тепла, образованием солей и наблюдением реакций обмена ионами. Ключевым фактором в данной реакции является активность щелочных металлов, которая позволяет им вступать в реакцию даже с умеренно активными кислотами.
Применение щелочных металлов и их соединений в различных сферах

Щелочные металлы, такие как литий, натрий, калий, являются самыми активными химическими элементами. В силу своей высокой реактивности, они находят широкое применение в различных сферах нашей жизни.
В фармацевтической промышленности щелочные металлы используются для создания лекарственных препаратов. Например, литий используется в качестве стабилизатора настроения при лечении психических расстройств. Калий широко применяется в виде добавок в пищевую промышленность для компенсации его дефицита в организме. Натрий используется для получения различных солей, применяемых в процессе производства лекарственных препаратов и косметических средств.
В энергетической отрасли щелочные металлы и их соединения применяются в качестве компонентов электродных материалов для литий-ионных аккумуляторов. Литий-ионные аккумуляторы широко используются в мобильных устройствах, электромобилях и даже в хранении энергии от возобновляемых источников, таких как солнечные батареи.
В металлургической промышленности щелочные металлы применяются для очистки металлов от примесей и получения сплавов с определенными характеристиками. Калий используется в процессе производства алюминия и стали, а натрий – при получении сверхпроводников и лазерных материалов.
Щелочные металлы также применяются в химической промышленности, например, для получения щелочей, таких как гидроксид натрия и калия. Эти вещества широко используются в бытовых и промышленных целях, например, в мыле, стекле, чистящих средствах, промышленных процессах и т.д.
Кроме того, щелочные металлы и их соединения применяются в процессе проведения научных исследований в различных областях, таких как физика, химия, биология и материаловедение. Они являются неотъемлемой частью многих экспериментов и лабораторных работ, благодаря своим уникальным свойствам и активности.
Вопрос-ответ

Какие щелочные металлы реагируют с кислотами?
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и рубидий (Rb), могут реагировать с кислотами. Эти металлы имеют высокую электроотрицательность и способны образовывать ионы водорода (H+), что позволяет им реагировать с кислотами.
Какие реакции происходят при взаимодействии щелочных металлов с кислотами?
При взаимодействии щелочных металлов с кислотами происходит образование солей и выделение водорода. Выражение этих реакций можно представить следующим образом: Металл + Кислота -> Соль + Водород. Например, реакция натрия (Na) с соляной кислотой (HCl) приводит к образованию соли хлорида натрия (NaCl) и выделению водорода.
