Щелочные металлы – это элементы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Основные свойства этих металлов – низкая плотность, низкая точка плавления и высокая электропроводность. В связи с этим возникает вопрос: являются ли щелочные металлы исключительно электропроводниками или у них есть и другие уникальные свойства?
Однозначно можно утверждать, что щелочные металлы являются отличными электропроводниками. Это объясняется особенностями их электронной структуры. Щелочные металлы имеют одну валентную электрону и обладают очень низкой электростатической энергией, что способствует повышенной подвижности электронов в их кристаллической решетке. Это позволяет щелочным металлам легко проводить электрический ток и являться отличными электрическими проводниками.
Однако, помимо этого основного свойства, щелочные металлы обладают и другими интересными химическими и физическими свойствами. Например, щелочные металлы образуют стабильные соединения с многими другими элементами, что позволяет использовать их в различных процессах и промышленных технологиях. Кроме того, щелочные металлы обладают высокой реактивностью и способностью легко взаимодействовать с кислородом, водой и другими веществами.
Основная информация о щелочных металлах

Щелочные металлы - это группа элементов, состоящих из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Они относятся к первой группе периодической системы и характеризуются низкой плотностью и низкой температурой плавления. Все щелочные металлы очень реакционны и взаимодействуют с кислородом воздуха, водой и большинством других веществ.
У щелочных металлов очень низкая электроотрицательность, что делает их хорошими электропроводниками. Они образуют одновалентные положительные ионы, теряя один электрон, и легко проводят электрический ток. Это делает их важными компонентами в электротехнике и батареях.
Щелочные металлы также характеризуются низкой твердостью и плохой устойчивостью к механическим воздействиям. Они имеют низкую плотность и обладают металлическим блеском. Из-за своей реакционности и высокой активности они обычно хранятся в масле или в среде инертного газа, чтобы предотвратить контакт с кислородом и водой.
Щелочные металлы также широко используются в производстве лекарств, стекла, мыла и многих других продуктов. Их соединения используются в сельском хозяйстве для улучшения почвы и в качестве катализаторов в химической промышленности.
В заключение, можно сказать, что щелочные металлы являются электропроводниками благодаря своей низкой электроотрицательности и способности образовывать одновалентные ионы, теряя один электрон. Они обладают высокой реакционностью, низкой твердостью и широким спектром применения в различных отраслях промышленности.
Состав щелочных металлов

Щелочные металлы представляют собой химические элементы первой группы периодической системы. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Характеризуются низкой плотностью, мягкостью и низкой температурой плавления.
Литий - самый легкий из щелочных металлов, обладает серебристо-белым цветом. Натрий имеет желтовато-светло-серый оттенок, калий - серебристо-серый, рубидий - синевато-фиолетовый, цезий - золотисто-желтый, а франций - серебристо-белый. Они очень реактивны и легко окисляются.
Входящие в состав щелочных металлов элементы обладают богатой электронной структурой, основанной на одиночной внешней оболочке с одним электроном. Это делает их очень активными химическими элементами. Щелочные металлы образуют положительно заряженные ионы в реакциях, что является причиной их хорошей электропроводности и способности образовывать соли.
Другой особенностью щелочных металлов является их способность образовывать сплавы, особенно со щелочно-земельными металлами. Это обусловлено их низкой температурой плавления и химической реактивностью.
Химические свойства щелочных металлов

Щелочные металлы обладают рядом уникальных химических свойств, которые определяют их роль в различных процессах и приложениях. Одной из характерных особенностей этих элементов является их способность образовывать ионы с положительным зарядом, т.н. катионы. Именно благодаря этому свойству щелочные металлы проявляются как хорошие электропроводники.
Другим важным свойством щелочных металлов является их реактивность. Они легко вступают в реакцию с водой, кислородом и другими веществами, получая тем самым ионы различной степени окисления. Например, калий и натрий при контакте с водой выделяются водород и образуют щелочные растворы, что свидетельствует о их щелочных свойствах.
Кроме того, щелочные металлы проявляют способность образовывать соединения с различными элементами и группами элементов. В результате этого образуются оксиды, гидроксиды, соли и другие соединения, которые широко применяются как сырье для производства химических продуктов, лекарственных препаратов и других материалов.
При реакции с кислотами щелочные металлы образуют соли, а при реакции с кислородом - оксиды и супероксиды. Эти процессы отражаются на свойствах полученных веществ и расширяют область их применения. Калий, натрий и литий используются в батареях, легированные сплавы с щелочными металлами находят применение в производстве электроники и солнечных панелей, ксантаты - в шахтной промышленности.
Физические свойства щелочных металлов

Щелочные металлы обладают рядом уникальных физических свойств, которые делают их одними из самых интересных элементов в периодической таблице.
1. Очень низкая температура плавления и кипения: Щелочные металлы, такие как литий, натрий и калий, имеют очень низкую температуру плавления и кипения. Например, калий плавится при температуре всего около 63 градусов Цельсия и кипит при примерно 770 градусах Цельсия.
2. Мягкость и пластичность: Щелочные металлы обладают высокой мягкостью и пластичностью. Они легко поддаются деформации и можно прокатывать в тонкие ленты. Это свойство делает их идеальными для производства многочисленных металлических изделий.
3. Воспламеняемость: Одной из наиболее известных особенностей щелочных металлов является их способность воспламеняться при контакте с воздухом или водой. Например, когда кусок натрия попадает в воду, он быстро реагирует, выделяя горючие газы. Это свойство позволяет использовать щелочные металлы в различных пиротехнических устройствах и аккумуляторах.
4. Высокая электропроводность и теплопроводность: Щелочные металлы являются отличными проводниками как электричества, так и тепла. Они обладают высокой подвижностью электронов, что позволяет электронам свободно передвигаться по структуре металла. Благодаря этому, щелочные металлы широко используются в электротехнике и теплотехнике.
5. Низкая плотность: Щелочные металлы обладают очень низкой плотностью. Например, литий, самый легкий щелочный металл, имеет плотность всего около 0,53 г/см³. Это делает их очень легкими и помогает снижать вес и объем конструкций, в которых они используются.
Электропроводность щелочных металлов
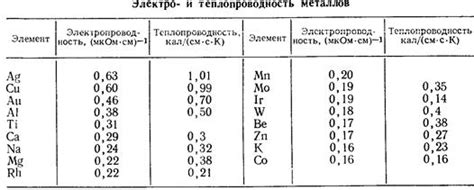
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, характеризуются высокой электропроводностью.
Электропроводность щелочных металлов обусловлена наличием свободных электронов в их атомной структуре. В общем случае, щелочные металлы имеют один электрон в валентной оболочке, который легко отдают, образуя катионы с положительным зарядом. Эти свободные электроны обеспечивают возникновение электропроводности.
Свободные электроны в щелочных металлах образуют электронное облако, которое переключается между атомами металла и создает электрический ток. Это облегчает передачу электрической энергии, делая щелочные металлы отличными проводниками.
Электропроводность щелочных металлов также может быть объяснена их кристаллической структурой. Щелочные металлы образуют кубическую решетку, в которой атомы металла находятся на регулярных расстояниях друг от друга. Это облегчает передачу электронов и создание электропроводности.
Важно отметить, что химические и физические свойства щелочных металлов могут влиять на их электропроводность. Например, литий имеет наибольшую электропроводность среди щелочных металлов из-за его наименьшего атомного радиуса и низкой энергии ионизации.
В целом, электропроводность щелочных металлов обусловлена наличием свободных электронов в их структуре и кристаллической решеткой, что делает их отличными электропроводниками.
Влияние условий окружающей среды на электропроводность щелочных металлов

Щелочные металлы, такие как литий, натрий и калий, являются хорошими электропроводниками в стандартных условиях. Однако их электропроводность может существенно изменяться под воздействием различных факторов окружающей среды.
Влажность воздуха играет важную роль в изменении электропроводности щелочных металлов. Влага может приводить к окислению поверхности металла, образованию оксидов и гидроксидов, что снижает электропроводность. При высокой влажности металлы могут образовывать гигроскопическую пленку, которая также может сдерживать ток.
Температура окружающей среды также влияет на электропроводность щелочных металлов. При повышении температуры металлы могут становиться более мягкими и податливыми, что снижает электропроводность. Возможны и обратные явления, например, при нагревании металлы могут образовывать оксидные пленки, увеличивающие электропроводность.
Щелочные металлы также могут взаимодействовать с другими веществами в окружающей среде, что влияет на их электропроводность. Например, щелочные металлы могут реагировать с кислородом, аммиаком или другими газами, образуя соли или соединения, которые могут снижать электропроводность.
Таким образом, условия окружающей среды существенно влияют на электропроводность щелочных металлов. Влажность, температура и взаимодействие с другими веществами могут изменять электропроводность металлов, что необходимо учитывать при их использовании в различных технических и научных приложениях.
Применение щелочных металлов как электропроводников

Щелочные металлы, такие как литий, натрий и калий, являются отличными электропроводниками и широко используются в различных областях.
В первую очередь, щелочные металлы применяются в производстве аккумуляторов. Их высокая электропроводность позволяет аккумуляторам хранить и выделять большое количество энергии. Литиево-ионные аккумуляторы, использующие литий в качестве электропроводника, имеют очень высокую энергетическую плотность и широко применяются в портативных электронных устройствах, электромобилях и других современных технологиях.
Кроме того, щелочные металлы используются в производстве ламп накаливания. Они служат внутренним электродом и обеспечивают электрическую проводимость в лампе. Натрий является основным компонентом в высокоэффективных натриевых лампах, которые широко применяются в уличном освещении и специализированных системах освещения.
В научных исследованиях, щелочные металлы также играют важную роль. Их способность проводить электричество позволяет исследователям создавать электропроводные материалы, которые могут использоваться в электронике, фотонике и других областях науки и техники.
Таким образом, щелочные металлы имеют широкое применение как электропроводники в различных отраслях, благодаря своей высокой электропроводности и другим полезным свойствам.
Риски и ограничения использования щелочных металлов как электропроводников

Щелочные металлы, такие как литий, натрий и калий, являются отличными электропроводниками благодаря своей высокой электропроводности и низкому сопротивлению электрическому току. Однако их использование сопряжено с определенными рисками и ограничениями.
- Реакция с влагой: Щелочные металлы очень реактивны и быстро реагируют с водой, образуя щелочные растворы и выделяя водород. Это может привести к возникновению опасных ситуаций, таких как взрывы или пожары.
- Коррозия: Щелочные металлы имеют высокую аффинность к кислороду, что делает их подверженными коррозии. При контакте с воздухом они быстро окисляются, образуя оксидные пленки, которые могут ухудшить электропроводность и даже повредить оборудование.
- Ядовитость: Щелочные металлы могут быть токсичными при попадании в организм человека. Более тяжелые щелочные металлы, такие как цезий и рубидий, могут вызывать серьезные проблемы со здоровьем, включая отравление и раковые заболевания.
- Экологические проблемы: Использование щелочных металлов может вызывать негативные последствия для окружающей среды. Отходы и выбросы этих металлов могут загрязнять воду, почву и воздух, оказывая вред на экосистемы.
В целом, использование щелочных металлов в качестве электропроводников требует тщательной оценки и учета рисков. Необходимо применять соответствующие меры предосторожности, такие как правильное хранение и обработка, чтобы минимизировать возможность возникновения опасных ситуаций и неблагоприятного воздействия на здоровье и окружающую среду.
Вопрос-ответ

Какие металлы относятся к щелочным?
Щелочные металлы включают литий, натрий, калий, рубидий, цезий и франций. Они находятся в первой группе периодической таблицы.
Почему щелочные металлы считаются электропроводниками?
Щелочные металлы хорошо проводят электрический ток из-за своей высокой электропроводности. Это связано с их электронной структурой и наличием только одного электрона во внешней электронной оболочке.
Каким образом щелочные металлы проявляют свою электропроводность?
Щелочные металлы обладают низкой ионизационной энергией, что означает, что они легко отдают свой внешний электрон другим атомам или ионам. Благодаря этому они способны сформировать ионные соединения с другими элементами и проявляют высокую электропроводность.
Есть ли какие-либо исключения в проводимости щелочных металлов?
Да, есть. Необычным исключением является литий - он отличается от других щелочных металлов большей твердостью, плотностью и высокой температурой плавления. Однако, он также проявляет хорошую электропроводность.
