Щелочные металлы – это химические элементы первой группы периодической таблицы, которые в своей основе имеют одну валентность и образуют ионы с положительным зарядом. К этой группе относятся такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Все щелочные металлы являются алкалиями, так как они реагируют с водой, образуя гидроксиды. Они также характеризуются низкой плотностью, низкой температурой плавления и высокой активностью. Кроме того, щелочные металлы обладают огромным потенциалом в химической промышленности и являются неотъемлемой частью многих технологических процессов.
Щелочные металлы можно классифицировать по различным признакам. Один из основных критериев – это плотность. Литий является самым легким из щелочных металлов, а калий и цезий – самыми плотными. Еще одним важным признаком является платиновая группа щелочных металлов, которую составляют калий, рубидий и цезий. Все они имеют платиново-серый цвет, высокую плотность и высокую химическую реактивность.
Что такое щелочные металлы?
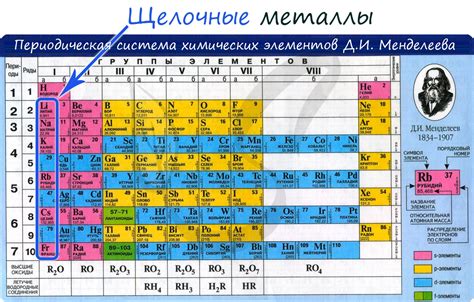
Щелочные металлы - это группа металлов, которые характеризуются очень высокой реактивностью и активностью в химических реакциях. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы имеют низкую плотность и низкую температуру плавления, что делает их легкими для обработки и использования в различных отраслях промышленности. Они также обладают отличной электропроводностью, что делает их полезными материалами в производстве батарей и других электронных устройств.
Щелочные металлы широко используются в химической промышленности для производства различных соединений, таких как гидроксиды, галогениды и соли. Они играют важную роль в жизни организмов, участвуя в многих биохимических процессах, включая передачу сигналов в нервной системе и сокращение мышц.
Химические свойства щелочных металлов определяются их способностью образовывать положительные ионы, потеряв один электрон. Это делает их очень реактивными с другими веществами, особенно с водой и кислородом.
Обзор щелочных металлов
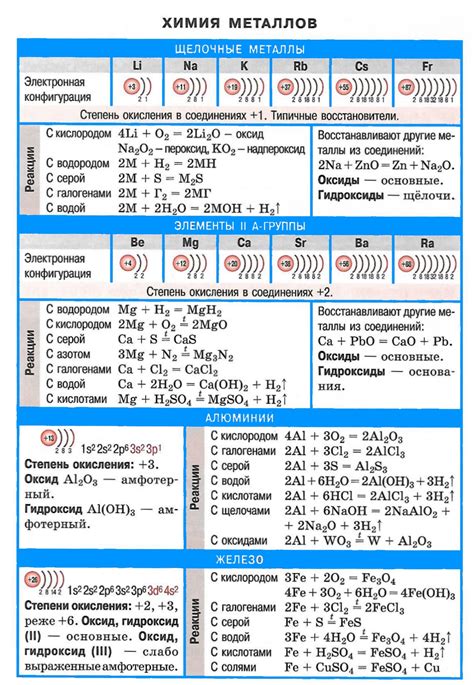
Щелочные металлы - это элементы, которые находятся в первой группе периодической таблицы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы являются одними из самых реактивных и химически активных элементов.
Щелочные металлы обладают рядом характеристик, которые делают их уникальными. Они обладают низкой плотностью, низкой температурой плавления и кипения, а также мягкой и гладкой текстурой. Их химическая реактивность проявляется в реакции с водой, кислотами и другими веществами.
Щелочные металлы широко применяются в различных областях. Например, литий используется в производстве литиевых батарей, натрий - в производстве стекла и щелочных растворов, а калий - в сельском хозяйстве и медицине.
Важным свойством щелочных металлов является их способность образовывать ионы с положительным зарядом. Это делает их полезными в процессе проведения электролиза и в производстве электричества.
В заключение, щелочные металлы представляют собой группу элементов, обладающих высокой химической активностью и широким спектром применения в различных отраслях промышленности и науки.
Физические свойства щелочных металлов

Щелочные металлы – это элементы, входящие в первую группу периодической таблицы. Они включают в себя литий, натрий, калий, рубидий, цезий и франций. Эти металлы обладают рядом характерных физических свойств, которые делают их уникальными и полезными в различных сферах жизни.
Первое физическое свойство щелочных металлов – низкая плотность. Они являются очень легкими металлами, что делает их привлекательными для использования в промышленности, например, в производстве легких конструкций или компонентов для авиации и космической отрасли.
Однако самым известным и удивительным физическим свойством щелочных металлов является их реакция с водой. Как правило, все щелочные металлы очень активно взаимодействуют с водой, выделяя газы и высвобождая большое количество тепла. Это свойство делает их опасными при неправильном обращении, но также предоставляет возможности для использования в различных химических реакциях и процессах.
Еще одним важным физическим свойством щелочных металлов является низкая температура плавления и кипения. Они очень легко плавятся и испаряются при относительно низких температурах, что также делает их полезными для различных технических и промышленных процессов.
В заключение, можно сказать, что физические свойства щелочных металлов делают их уникальными и полезными для многих отраслей науки, техники и промышленности. Их низкая плотность, активность при реакции с водой и низкая температура плавления и кипения открывают множество возможностей для использования этих металлов в различных областях жизни.
Химические свойства щелочных металлов

Воспламенение на воздухе: щелочные металлы активно реагируют с кислородом воздуха и могут воспламеняться при контакте с ним. Это связано с их высокой реакционной способностью и низкой энергией ионизации.
Взаимодействие с водой: щелочные металлы реагируют с водой, образуя гидроксиды и выделяя водород. Эта реакция является сильно экзотермической, то есть сопровождается выделением большого количества тепла.
Реакция с кислотами: щелочные металлы реагируют с кислотами, образуя соответствующие соли и выделяя водород. Это обусловлено химической активностью щелочных металлов.
Взаимодействие с неметаллами: щелочные металлы реагируют с неметаллами, такими как хлор, бром, йод, сера, образуя соответствующие соли. Реакция с халогенами особенно интенсивна и экзотермическая.
Амфотерные свойства: некоторые щелочные металлы, такие как алюминий и галлий, обладают амфотерными свойствами. Это означает, что они могут реагировать как с кислотами, так и с щелочами, образуя соли.
Классификация щелочных металлов
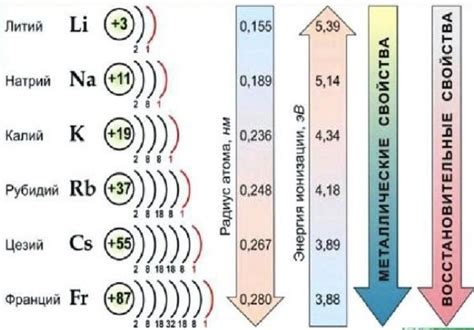
Щелочные металлы относятся к первой группе периодической системы элементов и включают литий, натрий, калий, рубидий, цезий и франций. Они являются наиболее активными металлами из всех элементов периодической системы. Все щелочные металлы химически реактивны и реагируют с водой, кислотами и галогенами.
Щелочные металлы можно подразделить на две подгруппы: литий, натрий и калий относятся к первой подгруппе, а рубидий, цезий и франций — ко второй подгруппе. Отличаются они в основном физическими свойствами, такими как плотность, температура плавления и кипения.
Первая подгруппа щелочных металлов (литий, натрий и калий) характеризуется более низкой плотностью, нижними значениями температуры плавления и кипения, а также меньшей активностью по сравнению со второй подгруппой. Они имеют меньшую энергию ионизации и более активно реагируют с водой и кислотами.
Вторая подгруппа щелочных металлов (рубидий, цезий и франций) отличается более высокой плотностью, более высокими значениями температуры плавления и кипения, а также большей активностью. Эти металлы имеют большую энергию ионизации и могут реагировать даже с водородом при комнатной температуре.
Таким образом, классификация щелочных металлов основана на их физических свойствах и химической активности. Первая подгруппа включает литий, натрий и калий, а вторая подгруппа — рубидий, цезий и франций. Понимание особенностей каждой подгруппы позволяет лучше понять свойства и поведение щелочных металлов в химических реакциях.
Классификация по атомному номеру

Щелочные металлы - это элементы периодической таблицы, относящиеся к первой группе. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Каждый из этих элементов имеет свой уникальный атомный номер, который отображает его место в периодической таблице.
Атомный номер - это количество протонов в атоме элемента. Классификация щелочных металлов по атомному номеру позволяет упорядочить их по возрастанию. Например, литий имеет атомный номер 3, что делает его самым легким щелочным металлом, а франций имеет атомный номер 87, что делает его самым тяжелым щелочным металлом. Таким образом, по мере увеличения атомного номера, масса и свойства щелочных металлов изменяются.
Классификация щелочных металлов по атомному номеру также позволяет определить закономерности в их химических свойствах. По мере увеличения атомного номера, щелочные металлы становятся более активными и реактивными. Например, литий, с наименьшим атомным номером, имеет наименьшую реактивность среди всех щелочных металлов, тогда как франций, с наибольшим атомным номером, является наиболее реактивным.
В целом, классификация щелочных металлов по атомному номеру позволяет упорядочить их по важным характеристикам, таким как масса, свойства и химическая активность. Это помогает исследователям и ученым лучше понять и использовать эти элементы в различных областях науки и технологии.
Классификация по химическим свойствам
Щелочные металлы – это группа элементов, которые характеризуются высокой химической активностью и способностью образовывать щелочные растворы.
Классификация щелочных металлов по химическим свойствам осуществляется на основе их взаимодействия с водой, кислородом и кислотами. Наиболее распространенными щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Взаимодействие с водой. Щелочные металлы обладают способностью реагировать с водой, образуя щелочные растворы. Эта реакция сопровождается выделением водорода и образованием гидроксидов щелочных металлов. Наиболее активными щелочными металлами являются литий и калий, которые реагируют с водой даже на холоду, в то время как калий реагирует более медленно.
Реакция с кислородом. Щелочные металлы реагируют с кислородом из воздуха, что приводит к образованию окислов щелочных металлов. Литий образует оксид Li2O, натрий – оксид Na2O, калий – оксид K2O, рубидий – оксид Rb2O, цезий – оксид Cs2O.
Взаимодействие с кислотами. Щелочные металлы реагируют с кислотами, образуя соли. Реакция может быть сопровождена выделением водорода. Например, литий и натрий образуют соли с соляной кислотой: LiCl и NaCl.
Таким образом, классификация щелочных металлов по химическим свойствам позволяет выделить основные характеристики и реактивность каждого металла в группе.
Вопрос-ответ

Какие элементы входят в группу щелочных металлов?
Щелочные металлы это элементы группы 1 периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они все характеризуются высокой реактивностью и низкой плотностью и имеют низкую точку плавления и кипения.
Какие свойства характерны для щелочных металлов?
У щелочных металлов есть несколько общих свойств. Они, как правило, имеют низкую плотность и низкую температуру плавления, что делает их мягкими металлами. Они также обладают высокой реактивностью и способны быстро реагировать с водой или кислородом. Щелочные металлы, такие как литий и натрий, также являются хорошими проводниками электричества и тепла.
Для чего используются щелочные металлы?
Щелочные металлы находят широкое применение в различных областях. Например, калий используется в сельском хозяйстве как удобрение, а также в производстве стекла и мыла. Литий широко используется в производстве литиевых ионных аккумуляторов, а также в фармацевтической и стекольной промышленности. Натрий используется в пищевой промышленности и для управления водным балансом в организмах.
Какова опасность использования щелочных металлов?
Щелочные металлы могут быть опасными при неправильном обращении с ними. Они могут реагировать с водой или кислородом, что приводит к выделению взрывоопасных газов. Кроме того, щелочные металлы могут выжигать кожу и вызывать раздражение глаз и дыхательных путей. Поэтому необходимо соблюдать особую осторожность при работе с ними и использовать соответствующие меры предосторожности.
Какие еще элементы классифицируются как щелочные металлы?
Помимо лития, натрия, калия, рубидия, цезия и франция, некоторые ученые также относят к щелочным металлам элементы, которые находятся во второй группе периодической системы, такие как магний (Mg) и кальций (Ca). Они имеют некоторые схожие свойства с щелочными металлами, хотя и не такие выраженные.
