Щелочные металлы – это элементы, которые относятся к первой группе главной подгруппы периодической системы. Эта группа состоит из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Щелочные металлы имеют ряд схожих химических свойств, что обусловлено общей электронной конфигурацией и принципом увеличения радиуса атомов по группе.
Основное химическое свойство щелочных металлов – их активность. Они очень реакционно взаимодействуют с водой, кислотами, кислородом и другими веществами. Их реактивность увеличивается при движении по группе, в связи с тем, что с ростом атомного радиуса увеличивается расстояние между электронами в внешнем энергетическом уровне. Это позволяет легче отдавать электроны и более активно взаимодействовать с другими веществами.
Взаимодействие щелочных металлов с водой является одной из их характерных реакций. При контакте с водой щелочные металлы реагируют с образованием щелочных гидроксидов (гидроксиды лития, натрия, калия и рубидия растворяются в воде, образуя щелочные растворы). Реакция проходит с выделением водорода и образованием коричневого цвета раствора, вызванного образованием пероксида щелочных металлов.
Химические свойства щелочных металлов

Щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) являются одной из основных групп в периодической системе химических элементов. Они обладают сходными химическими свойствами, которые определяются наличием одной электронной оболочки внешнего электронного слоя.
Активная реактивность и способность образовывать катионы. Щелочные металлы активно реагируют с водой, кислородом и галогенами, образуя соответственно щелочные гидроксиды, оксиды или пероксиды, и галогениды. Катионы щелочных металлов обладают единичным положительным зарядом и легко образуют соли с анионами других элементов.
Способность образовывать соединения с кислородом. Щелочные металлы активно взаимодействуют с кислородом, образуя оксиды или пероксиды. Например, образование пероксидов Li2O2, Na2O2, KO2 и т.д. это результат реакции щелочного металла с кислородом в атмосфере.
Способность образовывать аммиакаты. Щелочные металлы образуют аммиакаты, либо сами растворяются в аммиаке, что является важным для органического синтеза и получения аммиака взамен реакции Габера.
Способность формировать сплавы с ртутью. Щелочные металлы образуют сплавы с ртутью, которые широко используются в электродной и фотохимии.
Цветное пламя и широкое применение. Щелочные металлы при горении в пламени дают яркую окраску, что позволяет использовать их в пиротехнике и промышленных фирмах. Кроме того, щелочные металлы широко применяются в различных отраслях науки и промышленности, включая химию, электронику и металлургию.
Главная подгруппа периодической системы
Главная подгруппа в периодической системе химических элементов представляет собой группу элементов, состоящую из трех периодов: 1, 2 и блока d. Все элементы главной подгруппы обладают одним общим свойством - наличием одного электрона в определенной внешней электронной оболочке. Этот электрон называется валентным электроном и определяет химические свойства элемента.
Первая группа главной подгруппы периодической системы включает в себя щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все они относятся к металлам и характеризуются высокой реактивностью, низкой температурой плавления и кипения, а также хорошей проводимостью электричества и тепла.
Щелочные металлы образуют ионные соединения с кислотами, образуя соль и выделяя водород. Они также реагируют с водой, образуя гидроксиды и выделяя водород. При сжигании в воздухе они образуют оксиды, которые затем растворяются в воде и превращаются в гидроксиды.
Элементы главной подгруппы периодической системы имеют широкое применение в различных отраслях науки и промышленности. Например, калий используется в сельском хозяйстве как удобрение, натрий используется в промышленности для производства щелочей и стекла, а литий находит применение в производстве аккумуляторов, лекарств и смазочных материалов.
Сравнение щелочных металлов
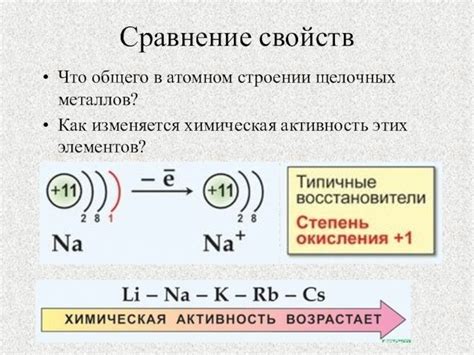
Щелочные металлы - это элементы первой группы главной подгруппы периодической системы. В этой группе находятся литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они имеют сходные химические свойства и образуют соединения с общей формулой MX, где M - щелочный металл, X - элемент из других групп.
Одно из главных сходств между щелочными металлами - это их высокая реактивность. Все они активно взаимодействуют с водой, образуя водород и оксид щелочного металла. При этом очередность активности и скорость реакции возрастает от лития к цезию. Литий реагирует самым медленным образом, а цезий - самым быстрым.
Другой общей характеристикой щелочных металлов является их способность образовывать оксиды и гидроксиды. Они образуются при взаимодействии металлов с кислородом или водой соответственно. Например, в результате реакции натрия с кислородом образуется оксид натрия (Na2O), а реакция натрия с водой приводит к образованию гидроксида натрия (NaOH).
Однако, помимо сходств, у щелочных металлов также есть некоторые различия. Например, их плотность и температура плавления возрастают с увеличением атомного номера. Литий имеет наименьшую плотность и низкую температуру плавления, а цезий - наибольшую плотность и высокую температуру плавления.
В заключение, можно отметить, что щелочные металлы обладают сходными химическими свойствами, но имеют некоторые различия. Изучение этих различий позволяет лучше понять химическую природу и особенности каждого из них.
Реакции щелочных металлов с водой

Щелочные металлы (литий, натрий, калий, рубидий и цезий) являются металлами первой группы главной подгруппы периодической системы. Они обладают высокой реактивностью и химической активностью, особенно во взаимодействии с водой.
Реакция щелочных металлов с водой является весьма характерной и сопровождается выделением водорода. Процесс начинается с момента контакта металла с водой, при этом металл быстро образует ион с положительным зарядом, а вода разлагается на отрицательно заряженные гидроксидные ионы и молекулы водорода.
К примеру, реакция натрия с водой выглядит следующим образом:
- 2Na + 2H2O → 2NaOH + H2
Образующийся гидроксид натрия растворяется в воде, образуя щелочную среду, а выделяющийся водород может воспламеняться при контакте с воздухом.
Реакции щелочных металлов с водой являются экзотермическими и сопровождаются выделением большого количества тепла. Это объясняет, почему реакция происходит с такой интенсивностью и иногда даже может приводить к взрывам, особенно при взаимодействии с более реактивными металлами, такими как калий и цезий.
Также стоит отметить, что реактивность щелочных металлов во взаимодействии с водой возрастает по мере движения по периоду, что связано с увеличением атомного радиуса и снижением энергии ионизации.
Использование щелочных металлов в промышленности

Литий - самый легкий из щелочных металлов. Он активно используется в промышленности благодаря своим уникальным химическим свойствам. Литий широко применяется в производстве аккумуляторов, так как имеет высокую электроотрицательность и большую энергетическую плотность. Кроме того, литий используется в производстве легких сплавов для авиационной и автомобильной промышленности, а также для создания керамических и стеклянных изделий.
Натрий - второе по распространенности щелочное металл. Он широко используется в промышленности, особенно в производстве щелочных и углеродатных соединений. Натрий является важным компонентом для изготовления стекла, мыла, хлорида натрия и многих других продуктов. Благодаря своим реакционным свойствам, натрий также используется в металлургической промышленности для очистки металлов от примесей.
Калий - один из наиболее распространенных щелочных металлов. Главное применение калия - в производстве удобрений. Благодаря своей способности повышать плодородие почвы, калий используется в сельском хозяйстве для увеличения урожайности. Калий также используется в производстве взрывчатых веществ, стекла и мыла. Его соединения находят применение в фармацевтической и пищевой промышленности.
Рубидий - меньше известен, однако имеет свои применения в промышленности. Рубидий используется в производстве катодов для электронных приборов, таких как телевизоры и мониторы. Он также может быть использован для создания оптических фильтров и вакуумных приборов. Кроме того, рубидий находит свое применение в проводах, катализаторах и некоторых металлических сплавах.
Цезий - редкий и дорогой щелочный металл, выборочно используется в промышленности. Цезий используется в некоторых специализированных электротехнических устройствах, таких как магнитные спектрометры и атомные часы. Кроме того, цезий может быть использован в некоторых типах вакуумных приборов и тепловых эмиссионных электродах.
В целом, щелочные металлы имеют широкий спектр применений в промышленности. Их химические свойства и реакционная способность позволяют использовать их для производства различных продуктов, от аккумуляторов и стекла до удобрений и специализированных электронных устройств.
Вопрос-ответ

Какие свойства характерны для щелочных металлов 1 группы главной подгруппы периодической системы?
Щелочные металлы 1 группы главной подгруппы периодической системы обладают рядом характерных свойств. Они являются самыми реактивными и мягкими металлами, которые легко реагируют с водой и воздухом. Щелочные металлы обладают низкой плотностью, низкой точкой плавления и кипения, а также низкой твердостью. Кроме того, они обладают металлическим блеском и низкой электроотрицательностью.
Какие свойства имеют щелочные металлы при реакции с водой?
При реакции щелочных металлов с водой образуется щелочь и выделяется водород. Эта реакция сопровождается значительным выделением тепла. С щелочными металлами 1 группы главной подгруппы периодической системы реакция с водой происходит очень быстро и интенсивно.
Какие соединения образуют щелочные металлы?
Щелочные металлы образуют различные соединения, включая оксиды, гидроксиды, карбонаты, нитриды, галогениды и многие другие. Например, гидроксиды щелочных металлов хорошо растворимы в воде и образуют щелочные растворы. Карбонаты и гидрокарбонаты щелочных металлов также являются растворимыми в воде и способны реагировать с кислотами.
Какие вещества реагируют с щелочными металлами?
Щелочные металлы реагируют с кислородом, водой, некоторыми галогенами (например, хлором), серой и многими другими веществами. Их реакционная способность обусловлена низкой электроположительностью и большой активностью электронов во внешней электронной оболочке.
