Щелочные металлы, такие как литий, натрий, калий и др., являются одной из самых важных групп элементов в периодической системе. Эти металлы привлекают особое внимание из-за своей высокой активности и широкого применения в химических реакциях.
Одной из ключевых особенностей щелочных металлов является их низкая ионизационная энергия, что делает их очень реактивными. Ионизационная энергия определяет энергию, необходимую для удаления одного электрона из атома щелочного металла. Благодаря этому свойству, щелочные металлы легко образуют ионы положительного заряда (катионы), которые играют важную роль в химических реакциях.
Щелочные металлы активно взаимодействуют с другими элементами и соединениями, образуя различные химические соединения. Их активность проявляется в способности реагировать с водой, кислородом, галогенами и другими веществами. Например, реакция щелочных металлов с водой приводит к выделению водорода и образованию щелочных гидроксидов. Эта реакция является хорошим примером иллюстрирующим активность щелочных металлов и их важную роль в многих химических процессах.
Важно отметить, что щелочные металлы также имеют широкое применение в различных отраслях науки и техники. Они используются в производстве батарей, стекла, лекарственных препаратов, сплавов и других материалов. Благодаря своей активности и уникальным химическим свойствам, щелочные металлы являются важными строительными кирпичиками в химической индустрии и имеют широкое применение в жизни человека.
Щелочные металлы: максимальная активность и ключевая роль в химических процессах

Щелочные металлы - это группа элементов, которые находятся в первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы отличаются своей высокой активностью и реактивностью, что делает их важными для множества химических процессов и реакций.
Максимальная активность щелочных металлов связана с наличием только одной валентной электронной оболочки, что делает их склонными к потере этого электрона и образованию катионов. Такая потеря электронов приводит к образованию ионов с положительным зарядом, что повышает их реактивность и способность к реагированию с другими веществами.
Щелочные металлы играют ключевую роль во многих химических процессах. Например, они часто используются в аналитической химии для определения концентрации различных веществ в растворах. Реактивность щелочных металлов также находит применение в промышленности, например, в процессе синтеза различных соединений и материалов.
Более того, щелочные металлы имеют широкое применение в медицине. Например, литий используется в лекарствах против биполярного расстройства, а калий является важным электролитом для поддержания нормальной работы клеток нашего организма.
В заключение, максимальная активность щелочных металлов и их ключевая роль в химических процессах делают их незаменимыми элементами во многих областях науки и промышленности. Это позволяет использовать их для создания новых материалов, препаратов и технологий, а также углублять наше понимание о химических свойствах и процессах в природе и искусственных системах.
Прочное знакомство с щелочными металлами
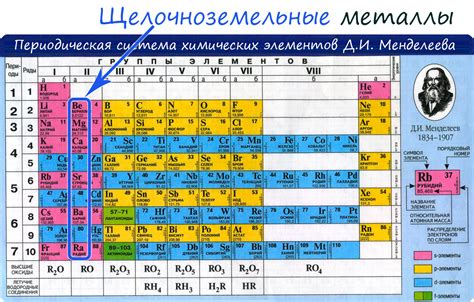
Щелочные металлы - это группа элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они являются самыми активными относительно других металлов в периодической таблице. Благодаря своей химической активности, щелочные металлы реагируют со многими веществами, образуя соединения и участвуя в различных химических реакциях.
Одной из особенностей щелочных металлов является их низкая электроотрицательность, что делает их хорошими ионогенами. Они легко теряют свои электроны, образуя положительно заряженные ионы. Это свойство щелочных металлов является основой для множества реакций и их участия в реакциях окисления и восстановления.
Щелочные металлы также известны своей реакционной способностью с водой. При взаимодействии с водой они образуют гидроксиды и выделяются водород. Например, реакция натрия с водой протекает с выделением пламени и образованием гидроксида натрия. Этим свойством щелочных металлов часто пользуются в лабораторных и промышленных процессах.
- Литий: является легким щелочным металлом, обладает способностью выделяться в виде искристого огня при контакте с водой.
- Натрий: широко используется в соли и щелочих, в том числе в пищевой промышленности.
- Калий: широко распространен в почвах и необходим для растений, а также используется в производстве удобрений.
- Рубидий: применяется в научных исследованиях, а также в производстве электроники.
- Цезий: наиболее реакционно активный щелочный металл, используется в некоторых научных исследованиях.
- Франций: самый редкий и реактивный щелочный металл, встречается естественно в незначительных количествах.
Изучение свойств щелочных металлов важно для понимания различных химических процессов и применения их в различных областях науки и технологий. Благодаря их химической активности и свойствам, щелочные металлы имеют широкий спектр применения, начиная от использования в батареях и электронике до производства стекла и удобрений.
Реакционная способность щелочных металлов
Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой реакционной способностью, что делает их важными участниками во многих химических реакциях.
Реакционная способность щелочных металлов обусловлена их электрохимической активностью. Они имеют одно валентностное электронное оболочку, которая легко отделяется, образуя положительный ион. Это позволяет щелочным металлам быстро реагировать с веществами, имеющими отрицательный заряд, такими как галогены (хлор, бром, йод) или кислород.
Щелочные металлы реагируют с водой, образуя гидроксиды и высвобождая водород. Например, реакция натрия с водой протекает по следующему уравнению:
2Na + 2H₂O → 2NaOH + H₂
Эта реакция очень экзотермическая, то есть сопровождается выделением значительного количества тепла. Поэтому при реакции между щелочным металлом и водой нередко наблюдается искра или пламень.
Щелочные металлы также реагируют с кислородом, образуя оксиды. Например, при сжигании натрия в кислороде образуется натрий пероксид:
4Na + O₂ → 2Na₂O₂
Кроме того, щелочные металлы могут образовывать соли, обладающие разнообразными свойствами. Их соли широко используются в различных областях, таких как медицина, пищевая промышленность и промышленность стекла.
Щелочные металлы в органической химии
Щелочные металлы, такие как литий, натрий, калий, радий и цезий, играют важную роль в органической химии. Они являются основными элементами, используемыми для создания различных органических соединений и реакций.
Реакция с карбонильной группой: Щелочные металлы обладают сильной основной активностью и могут реагировать с карбонильной группой (С=О) в органических соединениях. Например, они могут образовывать соль алкоксидов и алкилоксидов, которые могут быть использованы для дальнейших реакций.
Реакция с органическими галогенами: Щелочные металлы также могут реагировать с органическими галогенами, такими как хлор, бром и йод. Эти реакции позволяют заменить галогенов, что может быть полезно для синтеза различных органических соединений.
Реакция с гидроксидами: Щелочные металлы образуют гидроксиды, такие как луги, которые являются сильными основаниями в органической химии. Эти гидроксиды могут использоваться для гидратации и гидролиза органических соединений, а также для реагирования с кислотами.
Гетеролитическое разрывание связей: Щелочные металлы также могут производить гетеролитическое разрывание связей в органических соединениях. Например, они могут реагировать с алканами и диэфирами, разрывая связь и образуя алкоксиды и алкилоксиды.
В заключение, щелочные металлы играют важную роль в органической химии благодаря своей активности и возможности реагировать с различными органическими соединениями. Они способны участвовать в реакциях с карбонильной группой, органическими галогенами, гидроксидами и производить гетеролитическое разрывание связей. Это открывает широкие возможности для синтеза и модификации органических соединений с использованием щелочных металлов.
Что делает щелочные металлы особенно активными?
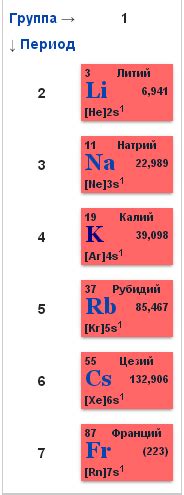
1. Электроотрицательность. Щелочные металлы, такие как литий, натрий и калий, обладают низкой электроотрицательностью, что делает их особенно активными в химических реакциях. Низкая электроотрицательность означает, что эти металлы имеют большую склонность отдавать свои электроны, образуя положительные ионы.
2. Отношение массы к заряду. Щелочные металлы имеют низкую относительную молекулярную массу и низкий заряд своих ионов, что делает их особенно реактивными. Небольшая масса и низкий заряд позволяют щелочным металлам эффективно взаимодействовать с другими элементами и соединениями.
3. Мягкость. Щелочные металлы являются мягкими металлами и обладают низкой температурой плавления и кипения. Эта особенность делает их особенно реактивными и обеспечивает легкость их включения в химические реакции.
4. Реактивность с водой. Щелочные металлы реагируют с водой, образуя гидроксиды и высвобождая водород. Эта реакция является одной из наиболее известных и показательных реакций щелочных металлов, демонстрирующих их высокую активность.
5. Химические свойства. Щелочные металлы характеризуются высокой реактивностью, что связано с их способностью образовывать ионы с положительным зарядом и связываться с другими веществами. Эти металлы обладают высокой способностью к окислению и участвуют во многих химических реакциях, включая образование солей и образование комплексных соединений.
Практическое значение щелочных металлов

Щелочные металлы, такие как натрий, калий и литий, имеют большое практическое значение в различных областях нашей жизни.
1. Производство щелочей и щелочных растворов: Щелочные металлы широко используются в промышленности для производства щелочей и щелочных растворов. Натрий, калий и литий являются основными компонентами гидроксидов, которые широко применяются в различных отраслях, таких как производство стекла, мыла, чистящих средств, удобрений и других химических продуктов.
2. Электролиты для аккумуляторов: Щелочные металлы, особенно литий, являются важными компонентами электролитов для различных типов аккумуляторов. Литиевые аккумуляторы, например, широко используются в мобильных телефонах, ноутбуках, электромобилях и других портативных устройствах благодаря высокой энергоемкости и стабильной работе.
3. Очистка металлов: Щелочные металлы используются в металлургической промышленности для очистки металлов от примесей и окислов. Гидроксиды щелочных металлов способны растворять некоторые оксиды и образовывать растворимые соли, что позволяет провести эффективную очистку поверхности металла.
4. Взаимодействие с водой: Щелочные металлы являются очень реактивными с водой, что делает их полезными в различных процессах. Натрий, калий и литий используются в пожаротушителях, так как реакция с водой приводит к выделению большого количества тепла и образованию газа, который может подавить огонь.
5. Использование в фармацевтической промышленности: Щелочные металлы широко используются в фармацевтической промышленности для производства многих препаратов. Натрий и калий часто используются в качестве компонентов в лекарственных средствах, а литий используется для лечения психических заболеваний, таких как биполярное расстройство.
Таким образом, щелочные металлы играют важную роль в нашей жизни и находят широкое применение в различных отраслях, от промышленности до медицины.
Примеры химических реакций с участием щелочных металлов
1. Реакция щелочного металла с водой: Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), реагируют с водой с образованием щелочного гидроксида и выделением водорода. Например, реакция натрия с водой протекает следующим образом: 2Na + 2H2O → 2NaOH + H2. Это яркий пример химической реакции, где активность щелочных металлов проявляется в их способности активно вступать в реакцию с водой.
2. Реакция щелочного металла с кислотой: Щелочные металлы могут реагировать с кислотами, образуя соли и выделяя газ. Например, реакция между натрием и соляной кислотой выглядит следующим образом: 2Na + 2HCl → 2NaCl + H2. В данной реакции натрий замещает водород в молекуле кислоты, образуя соль хлорида натрия и выделяя гидроген.
3. Реакция щелочного металла с кислородом: Щелочные металлы могут сжигаться на воздухе, образуя соответствующие оксидные соединения. Например, при сжигании калия в кислороде образуется оксид калия: 4K + O2 → 2K2O. Реакция происходит с выделением большого количества тепла и света, что делает ее яркой и заметной.
4. Реакция щелочного металла с хлором: Щелочные металлы реагируют с хлором, образуя хлориды. Например, реакция натрия с хлором протекает следующим образом: 2Na + Cl2 → 2NaCl. В данной реакции натрий замещает один из атомов хлора, образуя соль хлорида натрия, которая является химически стабильным соединением.
5. Реакция щелочного металла с водным раствором кислоты: Щелочные металлы реагируют с водными растворами кислот, образуя соли и воду. Например, реакция между натрием и серной кислотой протекает следующим образом: 2Na + H2SO4 → Na2SO4 + H2O. В данном случае натрий замещает водород в молекуле кислоты, образуя соль сульфата натрия и образуя воду.
Щелочные металлы активны в химических реакциях из-за их низкой энергии ионизации, что делает их более предпочтительными для вступления в химические реакции. Это обусловлено уровнем заполняемости электронной оболочки у щелочных металлов. Именно из-за своей активности щелочные металлы играют важную роль в различных процессах и реакциях, используемых в химической промышленности, энергетике и других отраслях жизнедеятельности человека.
Как сохранить безопасность при работе с щелочными металлами

1. Используйте лабораторный халат, защитные очки и перчатки. При работе с щелочными металлами, особенно с натрием и калием, необходимо использовать специальные средства защиты. Лабораторный халат поможет защитить от возможных брызг или попадания металлических частичек на кожу, а защитные очки предотвратят попадание искр или частиц в глаза. Не забудьте надеть перчатки из натурального каучука или другого подходящего материала для защиты рук от возможного контакта с щелочным металлом.
2. Работайте в хорошо вентилируемом помещении. Щелочные металлы могут выделять вредные газы при взаимодействии с воздухом или водой. Чтобы избежать их ингаляции, необходимо работать в хорошо проветриваемом помещении. Если это не возможно, используйте вытяжные системы или маски, которые снижают риск вдыхания вредных паров.
3. Храните щелочные металлы в специальном контейнере. Для безопасного хранения щелочных металлов необходимо использовать специальные контейнеры, которые могут удерживать их высокую реактивность. Эти контейнеры должны быть герметичными и защищать от взаимодействия с влагой или кислородом воздуха.
4. Избегайте контакта со взрывоопасными веществами. Щелочные металлы, особенно литий и калий, могут реагировать с водой или кислотами, создавая взрывоопасные смеси. Поэтому необходимо избегать контакта щелочных металлов с такими веществами. Если необходимо проводить реакции, которые включают в себя щелочные металлы, следует строго соблюдать инструкции и осторожно добавлять их в реакционные среды.
5. Правильно утилизируйте отходы. После окончания работы с щелочными металлами, необходимо правильно утилизировать все отходы, чтобы предотвратить возможное загрязнение окружающей среды. Стеклянные или пластиковые контейнеры, аккуратно закрытые и помеченные как содержащие щелочные металлы, должны быть переданы в специализированные учреждения или надежно храниться до утилизации.
Вопрос-ответ

Каковы основные свойства щелочных металлов?
Основные свойства щелочных металлов включают высокую реактивность, низкую плотность, низкую температуру плавления, мягкость и низкую электроотрицательность. Они также хорошо проводят электричество и тепло.
Почему щелочные металлы более активны в химических реакциях?
Щелочные металлы более активны в химических реакциях из-за своей низкой ионизационной энергии и низкого электроотрицательности. Эти факторы делают их активными окислителями, способными легко отдавать свои электроны другим элементам.
Почему щелочные металлы важны в химических реакциях?
Щелочные металлы важны в химических реакциях из-за своей способности образовывать ионы, которые играют роль катализаторов и структурных компонентов различных соединений. Открытие реактивности щелочных металлов было одним из ключевых моментов в разработке химической науки.
