Вторая группа главной подгруппы и щелочноземельные металлы включают такие химические элементы, как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Они расположены во втором периоде и находятся во второй группе в периодической системе Химических элементов.
Щелочноземельные металлы обладают сходными химическими свойствами, такими как активность и возможность образования ионов двухвалентных катионов. Эти металлы отличаются от металлов первой группы главной подгруппы тем, что они менее активны и их образование ионообразующих соединений происходит с меньшей легкостью.
Магний, кальций, стронций и барий широко распространены в природе и играют важную роль в различных процессах. Магний, например, является составной частью многих органических соединений, а также находит применение в производстве автомобилей и аэрокосмической промышленности. Кальций является важным компонентом костей и зубов, а также необходим для нормального функционирования нервной системы и мышц. Стронций используется в производстве световых эффектов и пиротехники, а барий применяется в радиологии для создания контрастных веществ при проведении рентгенологических исследований.
Вторая группа главной подгруппы и щелочноземельные металлы имеют большое значение как в науке, так и в промышленности. Их свойства и применение делают их незаменимыми в различных отраслях людской деятельности.
Свойства второй группы химических элементов
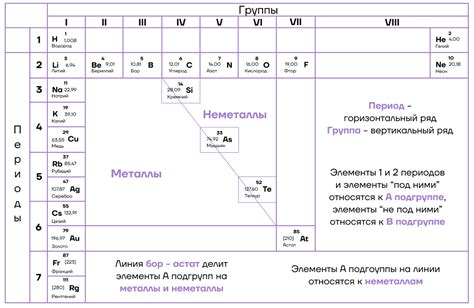
Вторая группа химических элементов таблицы периодов представлена щелочноземельными металлами: магнием (Mg), кальцием (Ca), стронцием (Sr), барием (Ba) и радием (Ra). Эти элементы обладают рядом схожих свойств, связанных с их атомной структурой и электронным строением.
Основными характеристиками второй группы химических элементов являются их металлические свойства. Они отличаются высокой проводимостью электричества и тепла, а также ярким блеском поверхности. Кроме того, щелочноземельные металлы обладают низкой температурой плавления и кипения, что делает их полезными материалами в различных областях промышленности и технологий.
Наиболее характерным свойством щелочноземельных металлов является их способность реагировать с водой. При этом они образуют щелочные оксиды, которые растворяются в воде и образуют щелочи. Это свойство является основанием для классификации второй группы элементов как щелочноземельных. Также интересно, что при реакции с водой происходит выделение газа водорода.
Щелочноземельные металлы хорошо растворяются в кислотах, образуя соли. Это свойство применяется в химической промышленности для получения различных соединений. Кроме того, щелочноземельные металлы являются важными компонентами в процессе производства стекла, а также в производстве специальных легких материалов, применяемых, например, в авиации и космической промышленности.
Обзор щелочноземельных металлов

Щелочноземельные металлы - это химические элементы, которые относятся ко второй группе периодической таблицы. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти элементы обладают рядом общих свойств и химической активностью.
Щелочноземельные металлы обычно имеют серебристо-белый цвет и мягкую текстуру. Они хорошо проводят тепло и электричество. Время полураспада щелочноземельных металлов варьируется от нескольких минут для радия до миллионов лет для бериллия.
Щелочноземельные металлы имеют низкую плотность и кипят и тают при относительно низких температурах по сравнению с другими металлами. Они также образуют стабильные оксиды, которые сложно восстановить.
Эти металлы имеют важное значение в различных промышленных отраслях. Например, магний применяется в автомобильной промышленности и в производстве лекарственных препаратов. Кальций используется для производства строительных материалов и в пищевой промышленности. Бериллий используется в производстве ядерных реакторов и в космической промышленности.
- Бериллий (Be)
- Магний (Mg)
- Кальций (Ca)
- Стронций (Sr)
- Барий (Ba)
- Радий (Ra)
В целом, щелочноземельные металлы представляют собой важный класс элементов, которые влияют на множество аспектов нашей жизни, от промышленной и строительной деятельности до медицинских и научно-исследовательских открытий.
Физические свойства щелочноземельных металлов

Щелочноземельные металлы являются мягкими металлами, обладающими характерными физическими свойствами. Они отличаются высокой электропроводностью и теплопроводностью, что делает их востребованными в различных областях промышленности.
Одной из особенностей щелочноземельных металлов является их низкая плотность. Например, магний имеет плотность всего 1,74 г/см3, что делает его одним из самых легких металлов.
Щелочноземельные металлы проявляют высокую реактивность, особенно при контакте с водой. Они активно вступают в реакцию с водой, образуя гидроксиды и выделяя водород. Это свойство делает их важными компонентами в процессе производства водорода.
Щелочноземельные металлы обладают способностью образовывать более одного оксида и гидроксида. Например, магний может образовывать оксиды MgO и MgO2, а кальций – CaO и Ca(OH)2. Это позволяет использовать эти металлы в различных процессах, включая производство строительных материалов и минеральных удобрений.
Другим важным физическим свойством щелочноземельных металлов является их хорошая пластичность и способность к легкой обработке. Они можно легко прокатывать, тянуть и лить, что делает их востребованными в производстве различных металлических изделий и конструкций.
Применение металлов из второй группы

Металлы из второй группы периодической таблицы, такие как магний, кальций, стронций и барий, находят широкое применение в различных областях промышленности и научных исследований.
Одним из основных применений магния является его использование в автомобильной промышленности. Магниевые сплавы, характеризующиеся легкостью и прочностью, применяются для создания легких и прочных деталей автомобилей, таких как двигатели и подвески. Кроме того, магний используется в производстве спортивных инструментов, например, гольфовых клюшек и рыболовных удилищ.
Кальций, стронций и барий широко применяются в химической промышленности. Кальций используется в качестве сырья для производства металла кальция, который находит применение в производстве алюминия, сплавов и пиротехнических смесей. Стронций и барий используются в производстве различных химических соединений, используемых в фармацевтической и электронной промышленности.
Металлы из второй группы также имеют применение в сельском хозяйстве. Кальций используется как добавка в почву для повышения ее плодородности и улучшения роста растений. Магний и стронций играют важную роль в фотосинтезе и ферментативных процессах растений, что влияет на качество и урожайность сельскохозяйственных культур. Барий, в свою очередь, используется в качестве индикатора в анализе почвы и воды.
Таким образом, металлы из второй группы играют значительную роль в различных сферах человеческой деятельности, от автомобильной промышленности до сельского хозяйства, и продолжают находить новые области применения благодаря своим уникальным свойствам и химическим реакциям.
Получение щелочноземельных металлов

Щелочноземельные металлы - это группа элементов в периодической системе, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они получаются из своих руд или минералов и имеют много применений, включая использование в легких сплавах, конструкционных материалах, военной промышленности и медицине.
Одним из способов получения щелочноземельных металлов, таких как бериллий, является метод сопряженного восстановления с использованием жидкого алюминия. В этом процессе оксиды щелочноземельных металлов реагируют с алюминием при высокой температуре. После реакции полученные металлы дистиллируют, чтобы получить их в чистом виде.
Магний получают из его минералов, таких как доломит и каменный магнезит. Вначале происходит их обжиг, в результате которого образуется окись магния (MgO). Затем окись магния подвергают восстановлению с помощью углерода или гидрогенизации, что позволяет получить магний в чистом виде.
Кальций можно получить из природных руд, таких как известняк или мел. Он получается путем плавления руды с добавлением коксующегося угля. После этого происходит электролиз, в результате которого получается кальций в жидком состоянии. Затем кальций охлаждают до твердого состояния и очищают от примесей.
Стронций, барий и радий также получают из своих природных руд путем химических реакций и восстановления. Однако, поскольку стронций, барий и радий являются редкими элементами, их получение является более сложным и дорогостоящим процессом.
Аллотропные модификации щелочноземельных металлов
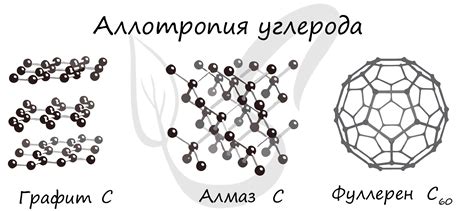
Щелочноземельные металлы - это элементы, находящиеся во второй группе главной подгруппы периодической системы. Эти металлы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Все эти элементы обладают аллотропными модификациями, то есть способностью существовать в разных формах с различными физическими и химическими свойствами.
Аллотропия - это явление изменения кристаллической структуры элементов при изменении условий окружающей среды или при действии внешних факторов, таких как температура и давление.
Аллотропные модификации щелочноземельных металлов могут иметь различное строение кристаллической решетки и разные физические свойства. Например, бериллий может существовать в аморфной и гексагональной кристаллических формах. Гексагональный бериллий обладает высокой прочностью и твердостью, что делает его полезным в производстве инструментов и сплавов.
Магний также имеет несколько аллотропных модификаций, в том числе гексагональную и кубическую структуры. Гексагональный магний используется в качестве легкого и прочного материала в авиации и автомобилестроении, а кубический магний применяется в производстве сплавов для улучшения их механических свойств.
Кальций и другие щелочноземельные металлы также имеют различные аллотропные модификации, но они менее изучены по сравнению с бериллием и магнием. Изучение аллотропии щелочноземельных металлов важно для понимания их свойств и возможного применения в разных отраслях промышленности.
Реактивность щелочноземельных металлов

Щелочноземельные металлы, которые включают в себя бериллий, магний, кальций, стронций, барий и радий, отличаются высокой химической активностью и участвуют во множестве разнообразных реакций.
Бериллий – самый легкий из щелочноземельных металлов и обладает наименьшей реактивностью. Он плохо растворяется в воде и образует ковалентные соединения. Бериллий реагирует с хлором, бромом и йодом, образуя соответствующие соли.
Магний обладает высокой реактивностью и активно реагирует с кислородом, образуя оксид магния (MgO). Он также может вступать в реакцию с хлором, серой и фосфором. Магний реагирует с водой только при нагревании, образуя гидроксид магния (Mg(OH)2) и выделяя водород.
Кальций – очень реактивный металл, который быстро и горящей искрой взрывается при контакте с водой. Он образует множество соединений, таких как оксид кальция (CaO), гидроксид кальция (Ca(OH)2) и соли с различными кислотами.
Стронций обладает схожей с кальцием реактивностью, активно реагируя с водой и образуя оксид стронция (SrO) и гидроксид стронция (Sr(OH)2). Он также реагирует с различными кислотами, образуя соли.
Барий – один из самых реактивных металлов. Он быстро реагирует с водой и образует оксид бария (BaO) и гидроксид бария (Ba(OH)2). Барий также образует множество соединений с кислотами.
Радий — самый редкий и наиболее реактивный металл из группы. Он относится к радиоактивным элементам и быстро превращается в другие элементы. Радий реагирует с водой, образуя оксид радия (RaO) и гидроксид радия (Ra(OH)2).
Влияние щелочноземельных металлов на органическую химию

Щелочноземельные металлы, такие как магний, кальций, стронций и барий, играют важную роль в органической химии. Они обладают рядом уникальных свойств, которые позволяют им вступать во взаимодействие с органическими соединениями и участвовать в различных химических реакциях.
Одним из основных свойств щелочноземельных металлов является их способность образовывать ионы с положительным зарядом. Эти ионы могут быть использованы в качестве катализаторов для органических реакций, что позволяет ускорить протекание химических процессов и повысить выход продукта.
Влияние щелочноземельных металлов можно наблюдать и в реакциях с органическими кислотами. Например, щелочноземельные металлы могут реагировать с карбоновыми кислотами, образуя соли. Этот процесс называется нейтрализацией и позволяет превратить кислоту в более устойчивое соединение.
Щелочноземельные металлы также могут служить важными компонентами в органическом синтезе. Например, они могут быть использованы для синтеза органических соединений с использованием газообразного аммиака. В этом случае щелочноземельные металлы играют роль активных катализаторов, способствуя образованию новых химических связей.
Таким образом, щелочноземельные металлы оказывают значительное влияние на органическую химию. Их свойства и реактивность позволяют использовать их в различных химических процессах и синтезе органических соединений.
Вопрос-ответ

Какие элементы входят во вторую группу главной подгруппы?
Во вторую группу главной подгруппы входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Каковы основные свойства щелочноземельных металлов?
Основные свойства щелочноземельных металлов включают высокую электропроводность, мягкость, химическую активность и склонность к образованию оксидов. Они также обладают низкой плотностью, низкой точкой плавления и высокой термической и электрической проводимостью.
