Щелочноземельные металлы – это группа химических элементов, которые находятся во второй группе периодической таблицы. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы имеют некоторые общие свойства, отличающие их от других элементов.
Несмотря на своё название, щелочноземельные металлы не являются щелочными. Они взаимодействуют с кислородом и формируют оксиды, которые проявляют щелочные свойства, но в самих металлах щелочная активность отсутствует. Следовательно, название "щелочноземельные" произошло от схожих свойств оксидов этих металлов с оксидами щелочных металлов.
Химические и физические свойства щелочноземельных металлов определяются их электронной структурой и реакционной способностью. Они обладают двумя электронами в валентной оболочке, что делает их химически активными. Однако, их активность ниже, чем у щелочных металлов.
Важно отметить, что эти металлы обладают значительными применениями в различных отраслях науки и промышленности. Например, бериллий используется в производстве лёгких и прочных конструкционных материалов, а магний – в авиационной и автомобильной промышленности. Кальций и стронций применяются в производстве сплавов, а барий используется в медицине и для получения электронных трубок.
Основные характеристики щелочноземельных металлов

Щелочноземельные металлы включают в себя элементы второй группы периодической таблицы, а именно: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают рядом характеристик, которые делают их отличными от других групп элементов.
Первая характеристика щелочноземельных металлов – это их низкая электроотрицательность. Это означает, что атомы щелочноземельных металлов имеют большую склонность отдавать электроны, что способствует их реактивности и реакционной способности.
Вторая характеристика связана с их химической реакционной способностью. Щелочноземельные металлы образуют ионные соединения с другими элементами, в основном образованием солей. Они реагируют с кислородом, водой, кислотами и другими веществами, что делает их полезными в различных промышленных и научных областях.
Третья характеристика связана с их физическими свойствами. Они являются мягкими металлами с низкой плотностью и низкой температурой плавления. Например, бериллий является наименее плотным металлом, а радий имеет самую низкую температуру плавления среди всех элементов.
Четвертая характеристика касается их распространенности в природе. Щелочноземельные металлы встречаются в различных минералах и горных породах, но в основном их находят в виде соединений, таких как карбонаты и сульфаты.
Учет этих основных характеристик позволяет понять, почему щелочноземельные металлы являются важными в областях науки, промышленности и технологий. Их свойства и реакции делают их незаменимыми в различных процессах и при создании различных материалов.
Первая группа периодической таблицы
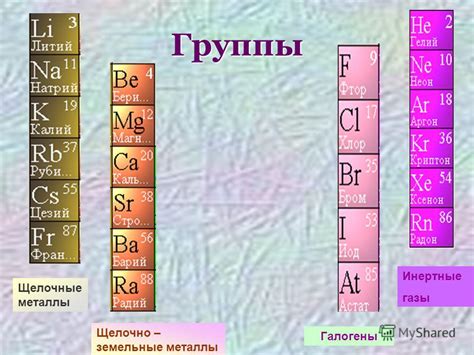
Первая группа периодической таблицы включает в себя элементы, которые относятся к щелочным металлам. Щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Литий (Li) находится в первой группе и имеет атомный номер 3. Он является наименее плотным из всех металлов и обладает большой химической активностью.
Натрий (Na) - металл с атомным номером 11. Он встречается в природе в виде солей и широко используется в промышленности и пищевой промышленности.
Калий (K) имеет атомный номер 19 и является одним из самых распространенных элементов в земной коре. Он играет важную роль в регулировании баланса воды в организме.
Рубидий (Rb) и цезий (Cs) - элементы с атомными номерами 37 и 55 соответственно. Они также относятся к щелочным металлам и обладают рядом полезных свойств, таких как использование в электронике и технологии.
Франций (Fr) - самый неустойчивый и редкий элемент из первой группы. Он имеет атомный номер 87 и изучение его свойств затруднено из-за его короткого периода полураспада.
Физические свойства щелочноземельных металлов

Щелочноземельные металлы - это элементы второй группы периодической таблицы, включающие бериллий, магний, кальций, стронций, барий и радий. Они обладают рядом характерных физических свойств, которые делают их уникальными.
Во-первых, щелочноземельные металлы имеют низкую плотность и малую твердость. Они обладают металлическим блеском и хорошей теплопроводностью. Часто они мягкие и гибкие, что делает их легко обрабатываемыми, но в то же время они достаточно прочны. Например, бериллий один из самых легких и жестких металлов.
Во-вторых, щелочноземельные металлы обладают высокой электропроводимостью и отличными свойствами до света. Они способны создавать яркие испарения или пламя в реакции с водой или кислородом. Например, магний горит ярко-белым пламенем, а стронций и барий часто используются для создания ярких огней в фейерверках.
В-третьих, щелочноземельные металлы имеют высокую сродство к кислороду и формируют оксиды, которые могут быть щелочными или амфотерными, в зависимости от элемента. Например, оксид кальция является щелочным (гидроксид кальция) и используется в строительстве для приготовления цемента и извести.
В-четвертых, щелочноземельные металлы имеют низкую температуру плавления и кипения. Они сохраняют свою металлическую структуру при высоких температурах и обладают низкими значениями коэффициентов термического расширения. Это делает их хорошими материалами для использования в высокотемпературных приложениях, например, в аэрокосмической промышленности и энергетике.
Таким образом, щелочноземельные металлы обладают разнообразными физическими свойствами, которые определяют их широкое использование в различных областях науки и техники.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы являются химически активными элементами, расположены второй группе периодической системы. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы обладают множеством уникальных свойств, которые делают их важными для промышленности и научных исследований.
Одной из характерных химических свойств щелочноземельных металлов является их способность образовывать ионы с двойным положительным зарядом (дивалентные ионы). Это связано с ионизацией двух внешних электронов. Они активно реагируют с водой и оксигеном, образуя гидроксиды и оксиды соответственно. Их частота реакций с водой и оксигеном возрастает по мере возрастания атомного номера в группе.
Бериллий обладает особыми свойствами, так как его ионы имеют двойное положительное зарядом и не образуют гидроксиды в водных растворах. Магний, кальций, стронций и барий образуют соответствующие гидроксиды: гидроксид магния (Mg(OH)2), гидроксид кальция (Ca(OH)2), гидроксид стронция (Sr(OH)2) и гидроксид бария (Ba(OH)2). Эти гидроксиды являются основаниями и широко используются в промышленности и домашнем хозяйстве.
Щелочноземельные металлы имеют высокую температуру плавления и кипения, что делает их полезными в процессах нагревания и плавления металлов. Они также обладают низкой плотностью и малой твердостью. Бериллий из всех щелочноземельных металлов обладает наибольшей твердостью.
В целом, щелочноземельные металлы являются важными и уникальными элементами в химии и промышленности. Их свойства и химическая активность делают их неотъемлемой частью многих процессов и научных исследований.
Щелочноземельные металлы: щелочные или амфотерные?
Щелочноземельные металлы - это элементы, расположенные во второй группе периодической системы. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). В отличие от щелочных металлов, которые образуют щелочные оксиды и гидроксиды, щелочноземельные металлы образуют ионные соединения, являющиеся амфотерными.
Щелочноземельные металлы имеют два энергетические уровня s-орбиталей, что делает их более электронегативными по сравнению с щелочными металлами. Это позволяет им образовывать ионные соединения с отрицательно заряженными анионами, такими как оксиды и гидроксиды, но также с положительно заряженными катионами, например, в воде или кислотах.
Вода является хорошим растворителем для щелочноземельных металлов, при взаимодействии они образуют гидроксиды, которые обладают амфотерными свойствами. Например, оксид бериллия обладает кислотными свойствами и реагирует с натрием, образуя натрий бериллат. В то же время, гидроксиды щелочноземельных металлов реагируют с кислотами, образуя соли и воду. Это делает щелочноземельные металлы амфотерными веществами.
Подводя итог, можно сказать, что щелочноземельные металлы образуют ионные соединения, которые могут проявлять как щелочные, так и амфотерные свойства, взаимодействуя с различными кислотами и основаниями. Их наличие в природе и важность в различных процессах делает щелочноземельные металлы важными элементами в химии и технологии.
Амфотерность их оксидов

Щелочноземельные металлы обладают особенностью амфотерности их оксидов. Амфотерность означает, что оксиды этих металлов могут образовывать как щелочные, так и кислотные соединения. Оксиды щелочноземельных металлов могут проявлять свои щелочные свойства в присутствии кислорода и иметь кислотные свойства в присутствии воды или кислотных растворов.
Примером кислотного свойства оксидов щелочноземельных металлов является оксид кальция (CaO), который при реакции с водой образует щелочную соль гидроксида кальция (Ca(OH)2). При этом реакции выделяется большое количество тепла.
С другой стороны, оксиды этих металлов могут быть растворены в кислотах, образуя соли и воду. Например, оксид магния (MgO) растворяется в соляной кислоте (HCl), образуя хлорид магния (MgCl2) и воду.
Амфотерность оксидов щелочноземельных металлов играет важную роль в многих технологических процессах, так как позволяет использовать эти металлы для получения различных химических соединений и материалов, а также для проведения реакций в различных средах.
Вопрос-ответ

Что такое щелочноземельные металлы?
Щелочноземельные металлы - это группа химических элементов, которые расположены во второй группе периодической системы Д. И. Менделеева. Эта группа включает в себя следующие элементы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы имеют сходные свойства, например, они легко образуют ионы с двойным положительным зарядом и реагируют с водой.
Химические элементы II группы периодической системы называются щелочноземельными металлами из-за щелочности их оксидов. Правда ли это?
Нет, это неправильное утверждение. Химические элементы II группы периодической системы называются щелочноземельными металлами, но не из-за щелочности их оксидов. На самом деле, название "щелочноземельные металлы" происходит от их групповой окислительной способности, которая находится между способностью алкалийных металлов и переходных металлов. Оксиды щелочноземельных металлов, такие как оксид кальция (CaO) и оксид магния (MgO), обладают щелочными свойствами, но это не является основной причиной названия.
Каким образом щелочноземельные металлы реагируют с водой?
Щелочноземельные металлы реагируют с водой, но не так активно, как алкалийные металлы. Например, кальций (Ca) реагирует с водой, образуя гидроксид кальция (Ca(OH)2) и выделяя водород (H2). Эта реакция происходит гораздо медленнее, чем реакция натрия (Na) или калия (K) с водой. Однако, щелочноземельные металлы всё же реагируют с водой, и их способность к этой реакции увеличивается с увеличением атомного номера.
