Щелочноземельные металлы - это группа элементов периодической системы, которые находятся во второй группе. В эту группу входят шесть элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы получили свое название благодаря своей реакционной способности с щелочами и способности образовывать оксиды с щелочной реакцией.
Щелочноземельные металлы обладают рядом общих характеристик. Они являются мягкими металлами, хорошими проводниками тепла и электричества. Они обладают низкой плотностью и низкой температурой плавления. Кроме того, они обладают химической реакционностью, которая увеличивается с увеличением атомного номера. Они часто образуют двухвалентные ионные соединения и сильно реагируют с кислородом, водой и другими неорганическими соединениями.
Щелочноземельные металлы имеют широкое использование в различных областях. Например, бериллий используется в производстве сплавов для аэрокосмической и автомобильной промышленности. Магний является важным компонентом в производстве автомобилей и во многих других отраслях промышленности. Кальций широко используется в строительстве, а стронций применяется в производстве огнетушителей и пиротехники.
Что такое щелочноземельные металлы?

Щелочноземельные металлы - это группа химических элементов из второй группы периодической таблицы, которые характеризуются своей реактивностью и особыми свойствами.
В состав этой группы входят следующие элементы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Щелочноземельные металлы обладают рядом уникальных химических и физических свойств. Они мягкие, легковоспламеняемые, хорошо проводят тепло и электричество. Большинство из них имеют серебристо-белый цвет и характерные металлические блеск.
Эти металлы реагируют с водой, образуя гидроксиды и высвобождая водород. Они также вступают в реакцию с кислородом, образуя оксиды. Благодаря своей активности, щелочноземельные металлы широко используются в промышленности, в производстве сплавов, в производстве батарей и в других областях.
Химические свойства

Щелочноземельные металлы обладают высокой активностью в химических реакциях. Они реагируют с водой, газами и многими другими химическими соединениями. Однако, их реакционная способность ниже по сравнению с щелочными металлами.
Взаимодействие щелочноземельных металлов с водой приводит к образованию щелочных гидроксидов и выделению водорода. Например, магний реагирует с водой, образуя гидроксид магния и выделяя водород.
Щелочноземельные металлы реагируют с кислородом воздуха, образуя оксиды. Например, кальций при взаимодействии с кислородом образует оксид кальция, выделяя при этом значительное количество тепла.
Одной из характеристик щелочноземельных металлов является их способность образовывать соли, которые обладают характерными свойствами. Например, соль магния (хлорид магния) применяется в медицине, а соль бария (хлорид бария) используется в качестве реагента в химическом анализе.
Также щелочноземельные металлы способны образовывать комплексные соединения, обладающие различными физическими и химическими свойствами. Например, соединение магния с аммиаком образует комплекс, который используется в производстве катализаторов и промышленных реагентов.
Активность щелочноземельных металлов

Щелочноземельные металлы характеризуются высокой активностью, что обусловлено их положением в периодической таблице и особенностями электронной конфигурации.
Все щелочноземельные металлы реагируют с водой, но их активность увеличивается с увеличением атомного номера. Например, бериллий образует слабо щелочную среду при реакции с водой, в то время как стронций и барий образуют более щелочную среду. Кроме того, щелочноземельные металлы могут реагировать с кислородом, азотом, а также с рядом других веществ.
Щелочноземельные металлы способны образовывать соединения с различными элементами, включая галогены и кислород. Например, оксиды щелочноземельных металлов обладают щелочными свойствами и используются в различных областях промышленности, включая производство стекла и керамики. Кроме того, растворимые галогениды щелочноземельных металлов применяются в медицине и в других отраслях науки и техники.
Активность щелочноземельных металлов также проявляется при взаимодействии с кислородом атмосферы. Металлы, такие как магний и кальций, при взаимодействии с воздухом образуют оксидные пленки на своей поверхности, которые защищают металлы от дальнейшего окисления.
Все эти свойства делают щелочноземельные металлы важными и широко используемыми элементами в различных областях промышленности, науки и техники.
Реакция со водой

Щелочноземельные металлы (бериллий, магний, кальций, стронций, барий и радий) реагируют с водой, образуя гидроксиды и выделяя водород. Реакция происходит с различной интенсивностью в зависимости от каждого конкретного металла.
Например, реакция магния с водой проходит довольно медленно. При этом на поверхности металла образуется тонкая слюда гидроксида магния, которая защищает металл от дальнейшего окисления. В результате водород освобождается в виде маленьких пузырьков, которые поднимаются вверх.
Кальций более активно реагирует с водой, из-за чего процесс происходит более быстро и с выделением большего количества пузырьков водорода. Также в результате реакции образуется белая осадок гидроксида кальция, который не растворяется в воде и остается на поверхности металла.
Наибольшая активность проявляется у бария и радия. При контакте с водой они реагируют с огнем и ярким свечением, образуя гидроксиды и высвобождая большое количество водорода. Эти реакции являются очень опасными и требуют особого внимания и мер предосторожности.
Физические свойства

Щелочноземельные металлы - это группа химических элементов, обладающих рядом сходных физических свойств. Они характеризуются серебристым блеском и мягкостью, легкостью реагировать с водой и кислородом, а также высокой электропроводностью.
Все щелочноземельные металлы имеют низкую плотность, что делает их легкими и податливыми. Они также обладают низкой температурой плавления и кипения, что позволяет им применяться в различных областях, например, в производстве сплавов и легких конструкций.
У щелочноземельных металлов имеются высокие точки плавления и кипения галогенидов. В чистом виде они обладают высокой вязкостью и плохо поддаются обработке. Кроме того, они обладают рядом специфических свойств, таких как аллотропия и способность к формированию оксидов различной степени окисления.
Щелочноземельные металлы имеют очень низкую электроотрицательность, что делает их хорошими веществами для проведения электричества. Их высокая электропроводность позволяет использовать их в производстве электродов и проводников. Кроме того, они являются хорошими катализаторами, способными активировать различные химические реакции.
Плотность и температура плавления
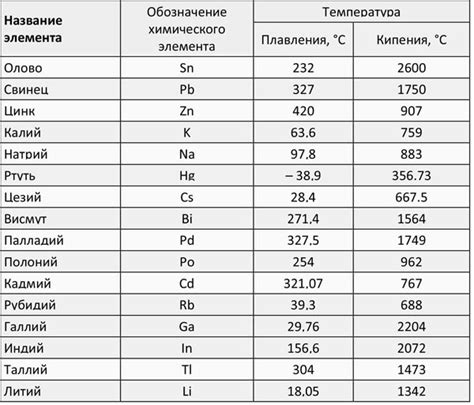
Щелочноземельные металлы характеризуются высокой плотностью. Наибольшей плотностью среди них обладает барий - около 3,51 г/см³. Магний и кальций имеют плотность около 1,74 г/см³, стронций - около 2,54 г/см³, а рентгений - около 4,50 г/см³. Плотность щелочноземельных металлов зависит от их атомной массы и компактности атомной решётки.
Температура плавления щелочноземельных металлов также различна. Наименьшую температуру плавления имеет магний - около 650 °C. Затем следуют кальций (около 842 °C), стронций (около 769 °C) и барий (около 727 °C).
Рентгений является исключением: он обладает достаточно высокой температурой плавления, превышающей 930 °C. Увеличение атомной массы щелочноземельного металла приводит к повышению его температуры плавления, что связано с укреплением взаимодействия между атомами вещества.
Проводимость тепла и электричества
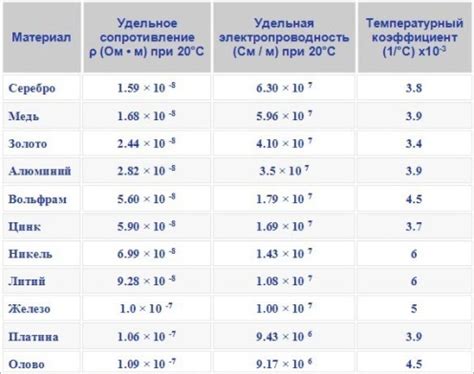
Щелочноземельные металлы обладают высокой проводимостью тепла и электричества.
Это свойство обусловлено структурой и химическими свойствами данных элементов. Щелочноземельные металлы имеют металлическую структуру, в которой положительно заряженные ионы металла образуют решетку, внутри которой свободно движутся электроны.
Именно электроны являются носителями электрического заряда и основной причиной проводимости электричества в металлах. Они образуют электронное облако вокруг положительных ионов металла и могут свободно передвигаться по решетке без существенных перебоев.
Проводимость тепла в щелочноземельных металлах также высока. При нагревании электроны получают дополнительную энергию, что увеличивает их скорость и способность передавать тепло. Кроме того, в металлах существуют свободно движущиеся фононы - колебания атомов решетки. Они также способствуют проводимости тепла, передавая его от одних атомов к другим.
Применение

Щелочноземельные металлы имеют широкое применение в различных отраслях науки и техники.
Магний используется в производстве легких сплавов, сплавов для производства авиационных и автомобильных деталей, а также в производстве аккумуляторных батарей.
Кальций применяется в сельском хозяйстве для улучшения почвы и грунта, а также в производстве стали и алюминия.
Стронций используется в производстве пиротехнических смесей, пигментов для красок, радиоактивных источников энергии.
Барий применяется в производстве стекла высочайшей оптической прозрачности, рентгеновских и радиационных экранов.
Радий применяется в исследовательских целях, в производстве радиоактивных источников энергии и в медицине.
Кроме того, эти металлы используются в производстве световых элементов, специальных жаропрочных материалов, в процессе очистки воды и воздуха, а также при производстве прочных и легких материалов.
Магний в авиации

Магний является одним из ключевых компонентов в производстве авиационных материалов и компонентов благодаря своим уникальным свойствам и химической стабильности.
Этот легкий металл обладает высокой прочностью при низком весе, что делает его идеальным материалом для использования в авиационной индустрии. Благодаря своей низкой плотности, магний позволяет создавать легкие и прочные компоненты и конструкции, снижая вес самолета и улучшая его маневренность и топливную эффективность.
Сплавы магния также отличаются высокой коррозионной стойкостью, что особенно важно для авиационных материалов, которые подвергаются агрессивным воздействиям окружающей среды, таким как высокая влажность, химические вещества и экстремальные температуры. Это обеспечивает обладающими магнием компонентами надежность и долговечность.
Магний также применяется в производстве легких сплавов с другими металлами, такими как алюминий и титан, для улучшения их механических свойств. Это позволяет создавать более прочные и легкие детали и компоненты, которые используются в авиационной индустрии.
Все эти свойства магния делают его неотъемлемым материалом для производства авиационных компонентов и способствуют развитию более эффективных и безопасных воздушных судов в мировой авиационной индустрии.
Кальций в строительстве

Кальций является одним из самых распространенных элементов, используемых в строительстве. Он широко применяется как строительный материал благодаря своим уникальным свойствам.
Одним из основных применений кальция в строительстве является его использование для производства цемента. Кальций окисляется во время процесса горения известняка и образует кальцийоксид, который является основным компонентом цемента. Цемент является основным строительным материалом и используется для создания бетона, который широко применяется в строительных конструкциях.
Кальций также используется в процессе отделки строительных поверхностей. Например, известь, которая содержит кальций, используется для создания штукатурки и красок. Кальций придает этим материалам прочность и устойчивость к воздействию окружающей среды.
Кроме того, кальций используется для производства стекла. Кальций добавляется в стеклянные изделия, чтобы придать им прозрачность и прочность. Таким образом, кальций играет важную роль в создании окон, зеркал и других стеклянных конструкций, которые являются неотъемлемой частью современного строительства.
Использование кальция в строительстве позволяет создавать прочные и долговечные конструкции. Благодаря своим уникальным свойствам, кальций играет ключевую роль в процессе строительства и улучшает качество и надежность строительных материалов.
Вопрос-ответ

Какие элементы входят в группу щелочноземельных металлов?
В группу щелочноземельных металлов входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
В чем особенность щелочноземельных металлов?
Особенностью щелочноземельных металлов является их высокая активность, что связано с легкостью отдачи двух внешних электронов в химических реакциях.
Какие свойства имеют щелочноземельные металлы?
Щелочноземельные металлы обладают следующими свойствами: мягкость, низкую плотность, малую температуру плавления и кипения, высокую химическую реактивность, способность образовывать ионы с двойным зарядом.
Где можно найти щелочноземельные металлы в природе?
Щелочноземельные металлы встречаются в природе в различных минералах и рудах. Например, бериллий можно найти в минерале берилле, магний - в минерале серпентинит, а кальций - в известняке и мраморе.
