Щелочноземельные металлы - это элементы второй группы периодической таблицы Менделеева. Они обладают общей химической характеристикой - высокой активностью, что связано с наличием двух валентных электронов на внешнем энергетическом уровне. Однако не все щелочноземельные металлы образуют пероксиды, включая щелочные металлы могут формировать соединения, обладающие такими свойствами.
Пероксиды - соединения, содержащие анион O2²⁻. Они обладают химическими и физическими свойствами, которые существенно отличаются от свойств других соединений. Взаимодействуя с водой, пероксиды могут образовывать кислород и обладают окислительными свойствами.
Список щелочноземельных металлов, способных образовывать пероксиды, включает магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы, благодаря своей химической активности, могут образовывать стабильные пероксидные соединения, такие как магниевый пероксид (MgO2), кальциевый пероксид (CaO2) и другие. Пероксиды этих металлов имеют широкий спектр применений в различных областях науки и промышленности.
Список самых распространенных щелочноземельных металлов
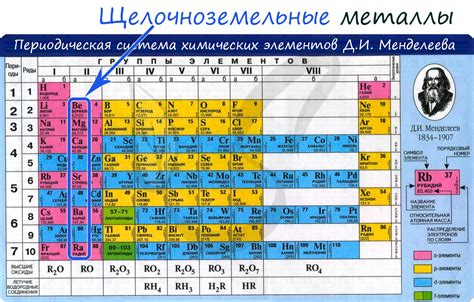
Щелочноземельные металлы — это химические элементы второй группы периодической системы, которые характеризуются высокой химической реактивностью и способностью образовывать ионы с двойным положительным зарядом. В этой группе четыре наиболее распространенных щелочноземельных металла — бериллий (Be), магний (Mg), кальций (Ca) и стронций (Sr).
Бериллий (Be) — легкий и прочный металл, который широко применяется в аэрокосмической и энергетической промышленности. Он имеет высокую теплопроводность и отличные механические свойства, что делает его идеальным для использования в конструкциях и инструментах, работающих в экстремальных условиях.
Магний (Mg) – легкий щелочноземельный металл, который широко используется в производстве алюминия и магниевых сплавов. Магний также находит применение в производстве батарей, солнечных панелей, порошков для пиротехники и вспышек для фотокамер.
Кальций (Ca) – щелочноземельный металл, который является одним из наиболее распространенных элементов в земной коре. Кальций играет важную роль в биологии, так как является необходимым элементом для строения костей и зубов. Он также используется в производстве стекла, цемента, железобетона и в пищевой промышленности в качестве добавки в пищу.
Стронций (Sr) – щелочноземельный металл, который широко используется в производстве пиротехнических изделий и световых фильтров. Стронций также находит применение в ядерной энергетике, а также в медицине для диагностики болезней костей и рака.
Это лишь небольшая часть списка самых распространенных щелочноземельных металлов, но они демонстрируют важность и разнообразие применения этой группы элементов в нашей жизни.
Почему пероксиды образуются только у щелочноземельных металлов?
Пероксиды образуются только у щелочноземельных металлов из-за особенностей электронной структуры атомов этих элементов. Щелочноземельные металлы, такие как бериллий, магний, кальций и др., обладают двуми валентными электронами в своей наружной электронной оболочке.
Данный факт делает их склонными к образованию ионов с положительным зарядом, а именно ионов двухвалентных катионов. Такие ионы имеют определенную энергию, способствующую образованию катион-анонного комплекса с кислородом, проводящего к образованию пероксидов. Кислород является активным анодом, а щелочноземельные металлы выступают в роли катода своих комплексов.
Пероксиды, образующиеся у щелочноземельных металлов, имеют формулу MO2, где M - металл щелочноземельных элементов. Эти соединения обычно являются белого цвета и обладают свойствами окислителей, что делает их полезными во множестве химических реакций и технологических процессах.
Таким образом, благодаря особенностям электронной структуры и ионизационным свойствам, щелочноземельные металлы способны образовывать пероксиды. Это приводит к ряду интересных физико-химических свойств и применений этих соединений в различных областях науки и промышленности.
Какие щелочноземельные металлы способны образовывать пероксиды?
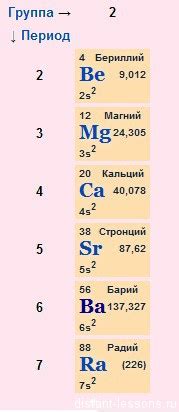
Щелочноземельные металлы — это группа химических элементов, состоящая из шести элементов: бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra). Они относятся к блоку s таблицы элементов и являются металлами соответствующего периода.
Из этих металлов только кальций (Ca), стронций (Sr) и барий (Ba) способны образовывать пероксиды. Пероксиды щелочноземельных металлов представляют собой соединения, содержащие группу О2^2-, которая является одним из стабильных оксидных анионов. В пероксидах щелочноземельных металлов, атомы металлов имеют степень окисления +2, а кислород — -1.
Пероксид кальция, CaO2, является наиболее известным и широко применяемым пероксидом щелочноземельных металлов. Он обладает свойствами окислителя и используется в химической промышленности и лабораторной практике. Стронциевый пероксид, SrO2, и пероксид бария, BaO2, также могут образовываться, но они менее стабильны и мало распространены в промышленности.
Следует отметить, что двух других щелочноземельных металлов, бериллия (Be) и магния (Mg), пероксиды образовывать не могут из-за их меньшей реакционной активности и более высокой электроотрицательности. Они формируют бинарные оксиды (оксид бериллия, BeO; оксид магния, MgO), но не пероксиды, при взаимодействии с кислородом.
Вопрос-ответ

Возможно ли, что щелочноземельные металлы образуют пероксиды?
Да, щелочноземельные металлы вполне способны образовывать пероксиды, так как они имеют два свободных электрона, которые могут участвовать в реакциях с кислородом.
Какие именно щелочноземельные металлы могут образовывать пероксиды?
В список щелочноземельных металлов, способных образовывать пероксиды, входят лишь металлы барий (Ba), стронций (Sr) и кальций (Ca), так как они имеют достаточно низкую ионизационную энергию, чтобы образовывать двухвалентные ионы и реагировать с кислородом.
Какие свойства обуславливают способность щелочноземельных металлов образовывать пероксиды?
Способность щелочноземельных металлов образовывать пероксиды обуславливается их низкой ионизационной энергией, что позволяет образовывать двухвалентные ионы, а также наличием двух свободных электронов, которые могут реагировать с кислородом.
Какие еще соединения могут образовывать щелочноземельные металлы, кроме пероксидов?
Щелочноземельные металлы могут образовывать различные соединения, включая гидроксиды, оксиды, супероксиды и пероксиды, в зависимости от условий реакции и доступности кислорода.
