Щелочноземельные металлы - это группа химических элементов, включающих в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они относятся к 2-й группе периодической системы элементов и обладают рядом общих свойств и характеристик.
Щелочноземельные металлы являются мягкими, легкими, и хорошо проводят тепло и электричество. Они имеют низкую плотность и температуру плавления, а также высокую химическую реактивность. Некоторые из них обладают специфическими свойствами, например, бериллий обладает высокой токсичностью, а радий является радиоактивным.
Щелочноземельные металлы имеют широкое применение в различных областях науки и техники. Например, бериллий используется для создания легких и прочных сплавов, а также в ядерной энергетике. Магний широко применяется в авиационной и автомобильной промышленности благодаря своим легким и прочным свойствам. Кальций используется в строительстве, медицине и пищевой промышленности. Стронций и барий применяются в производстве пиротехники и специальных стекол. Радий используется в радиотерапии и в бытовых радиоэлементках.
Щелочноземельные металлы играют важную роль в мире науки и промышленности благодаря своим уникальным свойствам и широкому спектру применения. Исследования и разработки в области этих металлов продолжаются, и мы можем ожидать новых открытий и применений в будущем.
Свойства и особенности щелочноземельных металлов
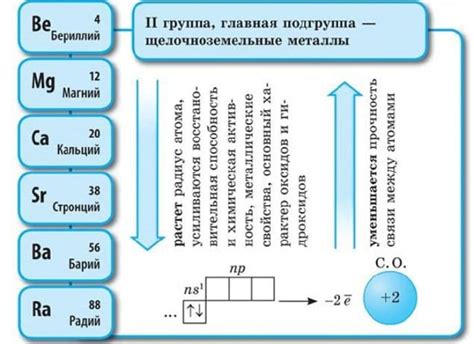
Щелочноземельные металлы – это группа элементов периодической системы, которая включает в себя бериллий, магний, кальций, стронций, барий и радий. Они относятся к химической группе, находятся во второй группе и обладают сходными химическими свойствами.
Первой особенностью щелочноземельных металлов является их низкая плотность. Это связано с их маленькой атомной массой и относительно большими атомами, что делает их легкими и хорошими материалами для конструкций, где важна низкая масса.
Вторая особенность щелочноземельных металлов – их высокая реакционность и активность. Они легко реагируют с кислородом, водой и многими другими веществами. Например, бериллий и магний образуют оксиды и гидроксиды при взаимодействии с водой. Кальций и барий реагируют с водой с выделением водорода.
- Третья особенность щелочноземельных металлов – их химическая реактивность и способность образовывать соединения. Они образуют соли с разными кислотами и обладают способностью образовывать комплексные соединения.
- Четвертая особенность – щелочноземельные металлы обладают металлическим блеском и хорошей электропроводностью. Они являются хорошими проводниками тепла и электричества.
- Пятая особенность щелочноземельных металлов – их способность образовывать ионы с положительным зарядом. Это связано с их небольшим размером и низкими энергиями ионизации.
Щелочноземельные металлы находят применение в различных областях. Кальций используется в строительстве и производстве цемента. Бериллий применяется в аэрокосмической промышленности из-за своей легкости и прочности. Магний используется в производстве сплавов и в различных электрических и механических устройствах.
Первый раздел: история и происхождение названия

Щелочноземельные металлы - это группа химических элементов, которая включает бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Их название происходит от их качественных и химических свойств.
Первым металлом из этой группы, который был открыт и получил свое название, был магний. Его открыли в 1755 году, когда исследовали магнезит - минерал, содержащий оксид магния. Магний получил свое название от латинского слова "magnes", которое означает "магнит", так как этот металл обладает магнитными свойствами.
Кальций - второй металл из этой группы, который был открыт и получил свое название. Его открыли в 1808 году во время исследования кальцита - минерала, содержащего карбонат кальция. Название "кальций" происходит от латинского слова "calx", что означает "известь". Кальций известен своими свойствами образовывать щелочные оксиды и гидроксиды.
Остальные металлы - бериллий, стронций, барий и радий - получили свои названия позже, когда исследователи открыли и исследовали их свойства и химическую природу. Их названия также связаны с их качествами и историческими обстоятельствами открытия.
Второй раздел: физические свойства щелочноземельных металлов

1. Плотность: Щелочноземельные металлы обладают низкой плотностью, которая увеличивается по мере движения от верхней группы (бериллий) к нижней (радий). Например, плотность магния составляет около 1,74 г/см³, а плотность радия - около 5,5 г/см³.
2. Температура плавления: Щелочноземельные металлы имеют низкую температуру плавления. В зависимости от конкретного металла, она может варьироваться от 450 °C (магний) до 700 °C (цезий). Это свойство делает их подходящими для использования в различных технологических процессах, включая производство сплавов и литейные процессы.
3. Мягкость: Щелочноземельные металлы являются мягкими и легко деформируемыми. Они могут быть разрезаны ножом или нарезаны на тонкие ленты. Некоторые из них, такие как магний и кальций, легко гнутся и могут принимать различные формы без образования трещин.
4. Отсутствие цвета: Щелочноземельные металлы обычно обладают серебристо-белым цветом. Их поверхность блестящая и хорошо отражает свет. Однако, при взаимодействии с воздухом некоторые металлы могут окрашиваться в различные цвета из-за окисления и образования оксидной пленки.
5. Электропроводность: Щелочноземельные металлы хорошие проводники электричества и тепла. Они обладают высокой электропроводностью, что делает их важными материалами для производства электродов в батареях, электрических проводов и других электротехнических устройств.
6. Растворимость: Щелочноземельные металлы образуют растворимые соли, которые легко растворяются в воде. Например, гидроксид кальция хорошо растворяется и используется в производстве строительных материалов, таких как цемент.
Итак, физические свойства щелочноземельных металлов делают их важными в различных областях науки и техники, включая металлургию, электротехнику, строительство и другие отрасли промышленности.
Третий раздел: химические свойства щелочноземельных металлов

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают рядом уникальных химических свойств, что делает их важными элементами в различных областях промышленности и науки.
Одним из характерных свойств щелочноземельных металлов является их способность образовывать ионы с положительным зарядом, легко отдающие электроны. Это свойство обусловлено электронной конфигурацией атомов этих металлов, где внешний энергетический уровень содержит два электрона.
Щелочноземельные металлы активно реагируют с кислородом, образуя оксидные соединения. Например, магний сгорает в воздухе с образованием белого порошка магниевого оксида. Это химическое свойство позволяет использовать металлы данной группы для изготовления специальных конструкционных материалов, например, магниевых сплавов.
Щелочноземельные металлы также реагируют с водой, образуя гидроксиды и выделяя водород. Это реакция происходит с выделением значительного количества тепла и стала основой для разработки специальных пирофорных сплавов, которые используются в различных применениях, например, в качестве инициаторов взрывчатых веществ или для создания искр.
Химические свойства щелочноземельных металлов также проявляются в их способности образовывать соли с различными кислотами. Например, гидроксиды щелочноземельных металлов растворяются в воде, образуя любимые ложки нейтральные растворы. Это свойство используется для получения солей щелочноземельных металлов, которые находят применение в производстве стекла, керамики и других материалов.
Четвертый раздел: реакционная способность щелочноземельных металлов

Щелочноземельные металлы обладают высокой реакционной способностью и активностью во взаимодействии с различными веществами. Без реакционной способности щелочноземельные металлы не смогли бы выполнять свои важные функции в природе и повседневной жизни человека.
Поскольку щелочноземельные металлы обладают двумя валентностями (+1 и +2), они способны образовывать различные химические соединения с другими элементами. Одним из наиболее известных примеров таких соединений являются гидроксиды щелочноземельных металлов, которые образуются при реакции этих металлов с водой.
Взаимодействие щелочноземельных металлов с кислородом приводит к образованию оксидов, которые являются основными компонентами многих минералов и горных пород. Например, оксиды кальция и магния образуются при сжигании соответствующих металлов в присутствии кислорода.
Реакционные свойства щелочноземельных металлов также проявляются при взаимодействии с различными кислотами. Они реагируют с кислотами, образуя соли и выделяя водород. Например, реакция магния с соляной кислотой приводит к образованию хлорида магния и выделению молекулярного водорода.
Благодаря своей реакционной способности и активности, щелочноземельные металлы находят широкое применение в различных областях. Их соединения используются в производстве стекла, глины, цемента, удобрений и других продуктов важных для промышленности и сельского хозяйства. Кроме этого, щелочноземельные металлы являются неотъемлемыми компонентами многих лекарственных препаратов и косметических средств.
Пятый раздел: распространение и нахождение в природе
Щелочноземельные металлы встречаются в природе в виде различных минералов и соединений. Они распространены по всему миру, но наибольшие запасы обнаружены на территории России, Китая и Канады.
Основными минералами, в которых содержатся щелочноземельные металлы, являются галит, каменная соль, гипсит, глинозем и другие. Природные источники щелочноземельных металлов также включают в себя руды, такие как барит, пьезоэлектрические материалы и другие.
Минералы, богатые щелочноземельными металлами, находятся как в бесплатной форме, так и в соединениях с другими элементами. Чтобы получить чистые металлы, требуется провести сложные химические процессы, такие как плавка, электролиз и дистилляция.
Значительные запасы щелочноземельных металлов позволяют использовать их в различных отраслях промышленности, в том числе в производстве сплавов, керамики, стекла, электроники и многих других областях. Они также находят применение в производстве лекарств, косметических средств и сельскохозяйственных удобрений.
Шестой раздел: основные применения щелочноземельных металлов

1. Кальций: Кальций очень важен для здоровья костей и зубов, поэтому его основным применением является использование в качестве пищевой добавки, а также в производстве лекарственных препаратов. Кальций также используется в строительной отрасли, для производства стекол и керамики.
2. Барий: Барий используется в производстве рентгеновских контрастных веществ, которые помогают в визуализации внутренних органов при проведении медицинских исследований. Барий также применяется в производстве специального стекла для защиты от радиации и в производстве пирофорных материалов.
3. Магний: Магний является легким и прочным металлом, поэтому его основное применение связано с производством авиационных и автомобильных деталей. Магний также используется в производстве сплавов, пиротехники, средств пожаротушения и антифризов.
4. Стронций: Стронций используется в производстве пиротехники, такой как фейерверки и светящиеся палочки. Он также применяется в производстве стекла, керамики, электроники и ядерной энергетики.
5. Радий: Радий применяется в медицине для лечения рака и в производстве люминесцентных материалов. Он также используется в часах и инструментах для измерения времени, так как обладает способностью излучать свет при взаимодействии с другими веществами.
Седьмой раздел: проблемы эксплуатации щелочноземельных металлов

Щелочноземельные металлы, такие как магний, кальций и стронций, обладают рядом особенностей и проблем при их эксплуатации. Одной из основных проблем является их быстрое окисление на воздухе. При контакте с кислородом щелочноземельные металлы реагируют, образуя окислы, которые покрывают металлическую поверхность и могут препятствовать дальнейшей реакции. Это может привести к снижению эффективности работы щелочноземельных металлов.
Другой проблемой является их реактивность с водой. Щелочноземельные металлы, особенно магний и кальций, реагируют с водой, образуя щелочные растворы и выделяя водород. Это может привести к образованию газов, что делает эксплуатацию данных металлов в некоторых условиях небезопасной.
Также необходимо учитывать высокую стоимость щелочноземельных металлов, особенно стронция. Это может существенно повлиять на стоимость и эффективность их использования в различных отраслях промышленности. Необходимость постоянного обновления и замены щелочноземельных металлов также может быть финансово нагрузкой для предприятий.
Выводящие устройства и специальные защитные покрытия могут быть использованы для снижения окисления щелочноземельных металлов. Для контроля реакции с водой могут применяться специальные реакционные среды или защитные покрытия. Работа над разработкой более дешевых альтернативных материалов для замены щелочноземельных металлов также активно ведется, чтобы уменьшить затраты и проблемы, связанные с их эксплуатацией.
Восьмой раздел: перспективы использования щелочноземельных металлов

Щелочноземельные металлы, такие как магний, кальций и стронций, обладают уникальными свойствами, которые делают их перспективными материалами для различных областей применения.
Одной из перспектив является использование этих металлов в авиационной и автомобильной промышленности. Благодаря своей низкой плотности и высокой прочности, магний может быть использован для создания легких, но прочных конструкций, что позволит снизить вес авиационных и автомобильных компонентов, что, в свою очередь, приведет к уменьшению расхода топлива и выбросов вредных веществ.
Другой перспективной областью использования щелочноземельных металлов является медицина. Кальций, например, является неотъемлемым элементом для здоровья костей и зубов. Он используется для производства препаратов, которые помогают предотвратить и лечить различные заболевания, связанные с костями и зубами. Кроме того, стронций является ключевым компонентом в некоторых препаратах для лечения рака костей.
Еще одной перспективой использования щелочноземельных металлов является производство водородных топливных элементов. Магний и кальций могут быть использованы в процессах, связанных с производством и хранением водорода. Это открывает новые возможности для использования водородной энергии в различных отраслях, таких как электроэнергетика и автономные источники энергии.
Таким образом, щелочноземельные металлы имеют широкие перспективы использования в различных сферах. Их уникальные свойства делают их ценными материалами для авиационной и автомобильной промышленности, медицины и развития водородной энергетики. Будущие исследования и разработки в области использования этих металлов могут принести значительные преимущества и вклад в развитие различных отраслей промышленности и технологий.
Вопрос-ответ

Что такое щелочноземельные металлы?
Щелочноземельные металлы - это группа химических элементов второй группы периодической таблицы. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы обладают сходными свойствами, такими как мягкость, низкую плотность и низкую температуру плавления. Они также реагируют с водой и кислородом, образуя оксиды и гидроксиды.
Какие свойства характерны для щелочноземельных металлов?
Щелочноземельные металлы обладают рядом общих свойств. Они имеют мягкую текстуру и серебристо-белый цвет. Они хорошо проводят электричество и тепло. Щелочноземельные металлы обладают низкой плотностью и низкой температурой плавления. Они легко окисляются воздухом, образуя оксидные пленки на своей поверхности. Они также реагируют с водой, образуя гидроксиды и выделяя водород.
В каких областях применяются щелочноземельные металлы?
Щелочноземельные металлы широко используются в различных отраслях промышленности. Например, магний используется в производстве легких сплавов, которые применяются в авиации и автомобильной промышленности. Кальций используется в производстве стали и сплавов. Бериллий используется в производстве ядерных реакторов и высокотехнологичных изделий, таких как лазеры и рентгеновские трубки. Щелочноземельные металлы также широко используются в производстве огнетушителей, факелов, фарфора, керамики и стекла.
