Щелочноземельные металлы - это элементы второй группы периодической системы, которые обладают особыми химическими свойствами. В эту группу входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Вопрос о том, являются ли щелочноземельные металлы газами или нет, часто возникает из-за их позиции в периодической системе и рядом с ними находящиеся газы.
На самом деле щелочноземельные металлы - это металлы, а не газы. Они обладают твердым состоянием при комнатной температуре и давлении. Однако некоторые из них имеют низкую плотность и низкую температуру плавления, что делает их легкими и легко испаряемыми при повышенных температурах.
Вместе с тем, следует отметить, что некоторые щелочноземельные металлы, такие как бериллий и магний, обладают некоторыми газообразными характеристиками. Например, бериллий при нагревании воздуха окисляется и выделяет ядовитый газ - оксид бериллия (BeO). Поэтому, в определенных условиях, можно говорить о газообразных свойствах некоторых щелочноземельных металлов, но в целом они все же являются металлами.
История открытия щелочноземельных металлов

Щелочноземельные металлы — группа химических элементов, которые находятся во II группе периодической таблицы Менделеева. Эту группу составляют бериллий, магний, кальций, стронций, барий и радий. Открытие данных металлов было важным шагом в развитии химии и науки в целом.
Открытие первых щелочноземельных металлов началось с изучения минералов и свойств, которые они обладают. В 1798 году французский химик Луи Никола Воклен провел эксперименты с минералом, который назывался бериллом. Он получил необычную соль, которую назвал "гликаумом". Позднее эта соль оказалась соединением бериллия. Таким образом, бериллий был первым щелочноземельным металлом, открытым человеком.
Открытие других щелочноземельных металлов происходило в течение следующих десятилетий. В 1808 году английский химик Генри Дэви открыл кальций и магний, используя электролиз водного раствора их соляной кислоты. Он назвал эти элементы "кальций" и "магний" соответственно.
В 1808 году Дэви также попытался получить магний при помощи разложения плавленого оксида магния. Однако этот метод закончился неудачей, и только в 1828 году французский химик Антуан Беккерель независимо получил магний, используя электролиз расплавленного хлорида магния.
Постепенно были открыты оставшиеся щелочноземельные металлы: стронций в 1808 году, барий в 1808 году, а радий – самый последний – в 1898 году французским ученым Пьером и Мари Кюри. Открытие и изучение данных элементов позволило расширить наши знания о химических свойствах и структуре веществ, а также создать новые применения для щелочноземельных металлов в промышленности и науке.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы – это элементы, входящие во вторую группу периодической таблицы. Они включают бериллий, магний, кальций, стронций, барий и радий. Эти металлы проявляют ряд характерных химических свойств, которые делают их важными в различных областях науки и техники.
Одним из основных свойств щелочноземельных металлов является высокая реактивность. Бериллий, магний и кальций, например, реагируют с кислородом воздуха и образуют оксиды соответственно BeO, MgO и CaO. Это свойство делает эти металлы полезными в процессах нагревания и сварки, а также в производстве различных материалов.
Другим важным химическим свойством щелочноземельных металлов является способность образовывать ионы с двойным положительным зарядом. Например, кальций образует ионы Ca2+, а магний образует ионы Mg2+. Это делает эти металлы полезными в процессах образования соединений и в качестве катализаторов в различных химических реакциях.
Щелочноземельные металлы также обладают высокой проводимостью тепла и электричества. Например, магний, кальций и барий являются отличными проводниками электричества. Эта свойство делает их полезными в различных электротехнических и электронных устройствах.
В заключение, щелочноземельные металлы обладают рядом химических свойств, которые делают их полезными в различных областях. Высокая реактивность, способность образовывать ионы с двойным положительным зарядом и высокая проводимость делают эти металлы важными компонентами в процессах нагревания, сварки, производства материалов и в электротехнике.
Реакция с водой

Щелочноземельные металлы являются активными элементами, которые реагируют с водой. Реакция этих металлов с водой протекает интенсивно и с большим выделением газа.
Самой характерной и реактивной является реакция кальция с водой. Кальций реагирует с водой, образуя гидроксид кальция и высвобождая водородный газ:
Ca + 2H2O → Ca(OH)2 + H2
Эта реакция происходит с выделением большого количества тепла и образованием белой кипящей пены.
Магний также реагирует с водой, но намного медленнее, чем кальций. Реакция магния с водой происходит только при нагревании:
Mg + 2H2O → Mg(OH)2 + H2
Остальные щелочноземельные металлы (бериллий, стронций, барий и радий) также реагируют с водой, но их активность постепенно уменьшается по мере прогресса по периоду.
Электрохимические свойства
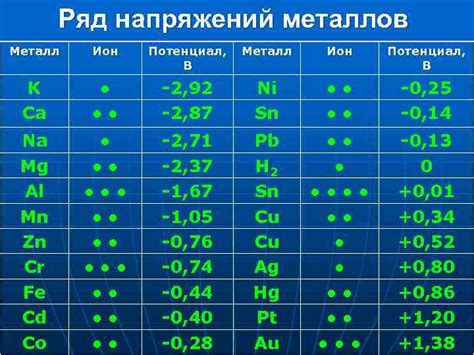
Щелочноземельные металлы - это элементы второй группы периодической системы, включающие бериллий (Be), магний (Mg), кальций (Са), стронций (Sr), барий (Ва) и радий (Ra). Они обладают интересными электрохимическими свойствами.
Все щелочноземельные металлы обладают высокими электроотрицательностями и имеют тенденцию терять электроны при взаимодействии с другими веществами. Они являются активными металлами, проявляя способность к реакциям с кислородом, водой и кислотами.
Бериллий, хотя и относится к щелочноземельным металлам, отличается от остальных элементов этой группы своими электрохимическими свойствами. Он обладает более высокой электроотрицательностью и меньшей реактивностью по сравнению с другими щелочноземельными металлами. Бериллий образует пассивную оксидную пленку, что делает его устойчивым к окислительным реакциям.
Магний и другие щелочноземельные металлы обладают способностью образовывать ионы с положительной зарядом, что делает их хорошими катодами в электрохимических процессах. Они могут проявлять активность в соединении с электролитами, протекать окислительные и восстановительные реакции и служить промежуточными продуктами в электролизе.
В целом, щелочноземельные металлы обладают значительными электрохимическими свойствами, которые определяют их взаимодействие с другими веществами и возможность использования в различных электрохимических процессах.
Физические свойства щелочноземельных металлов

Щелочноземельные металлы включают в себя металлы второй группы периодической системы - бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они получили свое название благодаря своей реактивности и сходству свойств с щелочными металлами первой группы.
Физические свойства щелочноземельных металлов частично определяют их положение в периодической системе. Они являются блестящими, мягкими, довольно легкими металлами с низкой плотностью. У них низкие температуры плавления и кипения, что делает их достаточно хорошо распространенными в природе.
Щелочноземельные металлы обладают высокой электропроводностью, что делает их полезными в различных электрических и электронных приборах. Они также обладают свойством образовывать стабильные ионные соединения, поэтому они широко используются в химической промышленности и в медицине.
Одним из важных физических свойств щелочноземельных металлов является их способность растворяться в воде с образованием щелочей. Например, кальций и магний образуют гидроксиды, которые используются в качестве щелочей. Эти металлы также образуют сплавы с другими металлами, что делает их важными компонентами в производстве различных сплавов и легированных материалов.
Сравнение с другими элементами
Щелочноземельные металлы отличаются особыми свойствами, которые выделяют их среди других элементов. Они являются второй группой периодической системы и состоят из шести элементов: бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra).
По сравнению с другими элементами, щелочноземельные металлы обладают более высокой плотностью и температурой плавления. Например, бериллий имеет плотность 1,85 г/см³, что делает его одним из самых легких металлов. В то же время, радий является самым тяжелым щелочноземельным металлом с плотностью 5 г/см³.
Основным отличием щелочноземельных металлов от газовых элементов, таких как водород (H), гелий (He), кислород (O) и азот (N), является их химическая активность. Щелочноземельные металлы активно реагируют с кислородом, образуя оксиды, которые могут быть сильными основаниями.
Кроме того, щелочноземельные металлы реагируют с водой, образуя гидроксиды и высвобождая водород. Такая реакция происходит более интенсивно, чем у щелочных металлов, но намного менее интенсивно, чем у щелочных металлов.
В целом, щелочноземельные металлы имеют свои уникальные химические и физические свойства, которые делают их полезными и важными элементами во многих отраслях промышленности и научных исследований.
Сравнение с щелочными металлами

Щелочноземельные металлы, как и щелочные металлы, являются основными элементами химической системы. Они обладают свойством образовывать катионы, обладающие двойным положительным зарядом, и легко реагировать с водой и кислородом.
Однако, в отличие от щелочных металлов, щелочноземельные металлы образуют менее реактивные катионы. Это связано с более высокой энергией ионизации у этих элементов.
Щелочноземельные металлы не обладают такой высокой реактивностью, как щелочные металлы, и образуют менее летучие соединения. Например, оксиды щелочноземельных металлов не газообразные, в отличие от оксидов щелочных металлов, которые образуют газы растворами воды.
Щелочноземельные металлы также обладают высокой плотностью и температурой плавления. Например, уравнение реакции щелочноземельного металла с водой выглядит следующим образом: 2M + 2H2O → 2MOH + H2, где M обозначает щелочноземельный металл. В результате такой реакции образуется гидроксид металла и выделяется водород.
Сравнение с переходными металлами
Щелочноземельные металлы и переходные металлы являются двумя большими группами элементов в периодической таблице. В то время как щелочноземельные металлы включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra), переходные металлы включают такие элементы, как железо (Fe), медь (Cu), цинк (Zn), никель (Ni) и многие другие.
Одним из главных различий между щелочноземельными и переходными металлами является их положение в периодической таблице. Щелочноземельные металлы находятся во второй группе, под литием (Li), в то время как переходные металлы находятся между группами IIIB и IVA.
Щелочноземельные металлы обычно обладают низкой электроотрицательностью и высокой реактивностью, что делает их хорошими веществами для синтеза органических соединений и других химических реакций. Переходные металлы, напротив, обычно обладают более высокой электроотрицательностью и обладают большей вариабельностью в своих химических свойствах.
Щелочноземельные металлы и переходные металлы также различаются в своих физических свойствах. Например, щелочноземельные металлы обладают низким плавлением и кипением, а также хорошей электропроводностью. Переходные металлы, с другой стороны, обычно обладают более высоким плавлением и кипением, а также различными магнитными свойствами.
Вопрос-ответ

Щелочноземельные металлы газы или нет?
Нет, щелочноземельные металлы не являются газами. Они являются металлами, а их химические свойства схожи с щелочными металлами. Они имеют металлический блеск, высокую плотность и проводимость тепла и электричества. Они легко реагируют с водой, образуя щелочное растворимое гидроксиды.
Можно ли считать щелочноземельные металлы газами?
Нет, щелочноземельные металлы не являются газами. Они относятся к группе металлов и обладают соответствующими химическими свойствами металлов, таких как блеск, проводимость и т.д. Щелочноземельные металлы легко реагируют с водой и образуют гидроксиды, но они не испаряются при обычных условиях и остаются в твёрдом состоянии.
Могут ли щелочноземельные металлы быть газообразными?
Нет, щелочноземельные металлы не могут быть газообразными. Они характеризуются металлическими свойствами, такими как блеск, проводимость тепла и электричества. Щелочноземельные металлы легко реагируют с водой, но они остаются в твёрдом состоянии и не испаряются при обычных условиях. Газообразные элементы находятся в других группах периодической таблицы.
