Атомный радиус щелочноземельных металлов является одним из основных характеристик, определяющих их физические и химические свойства. Щелочноземельные металлы - это элементы второй группы периодической системы, включающие бериллий, магний, кальций, стронций, барий и радий. Они имеют схожие химические свойства и обладают металлической структурой.
Атомный радиус - это расстояние от ядра атома до его внешних электронных оболочек. Поскольку атомы щелочноземельных металлов имеют простую структуру, слабое экранирование электронных оболочек и большие положительные заряды ядер, их атомные радиусы оказываются меньше, чем у других элементов.
Бериллий, обладающий наименьшим атомным радиусом среди щелочноземельных металлов, характеризуется высокой степенью ионизации и сильными связями между его атомами. Магний имеет уже немного больший атомный радиус и способен проявлять свои металлические свойства, такие как проводимость электричества и тепла.
Кальций, стронций, барий и радий обладают наибольшими атомными радиусами среди щелочноземельных металлов. Благодаря этому, они имеют низкую энергию ионизации и большую реакционную способность. Кальций широко используется в строительстве и в производстве сплавов, а барий применяется в медицине и радиологии. Радий - самый тяжелый и редкий элемент этой группы, известный своей радиоактивностью.
Атомный радиус щелочноземельных металлов

Атомный радиус щелочноземельных металлов является важным параметром, который характеризует размер атома данного элемента. Он является одним из основных свойств, определяющих химические и физические свойства этих металлов.
Щелочноземельные металлы включают в себя элементы второй группы периодической таблицы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают отличными металлическими свойствами, такими как хорошая электропроводность и теплопроводность.
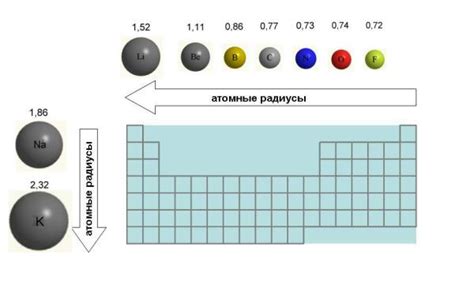
Атомный радиус щелочноземельных металлов увеличивается по мере движения вдоль периода таблицы. Например, у бериллия (Be) атомный радиус составляет около 112 пикометров (1 пикометр = 10^-12 метра), в то время как у радия (Ra) он равен примерно 215 пикометрам. Это объясняется увеличением количества электронных оболочек и сильно отрицательно заряженных ядер в атоме.
Сравнение атомных радиусов щелочноземельных металлов может также быть представлено в виде таблицы:
| Элемент | Атомный радиус (пикометры) |
|---|---|
| Бериллий (Be) | 112 |
| Магний (Mg) | 160 |
| Кальций (Ca) | 197 |
| Стронций (Sr) | 215 |
| Барий (Ba) | 222 |
| Радий (Ra) | 215 |
Из таблицы видно, что атомный радиус щелочноземельных металлов увеличивается по мере движения вниз по группе. Это объясняется увеличением количества электронных оболочек и усилением отталкивания между электронами и ядром. Больший атомный радиус также влияет на химические свойства этих металлов, например, на свободное протекание химических реакций и способность образовывать соединения с другими элементами.
Таким образом, атомный радиус щелочноземельных металлов является важным параметром для понимания и изучения их химических и физических свойств, а также их взаимодействия с другими элементами.
Определение и особенности
Атомный радиус щелочноземельных металлов представляет собой физическую характеристику, которая указывает на размер атома данного металла. Атомный радиус измеряется в пикометрах (1 пикометр = 10^-12 метра) и является важным параметром при изучении структуры и свойств вещества.
Особенностью атомного радиуса щелочноземельных металлов является его увеличение с увеличением атомного номера. Это связано с тем, что при движении по периоду атомов щелочноземельных металлов число электронов в внешней оболочке увеличивается, что приводит к увеличению отталкивающих электронных пар и, следовательно, к расширению атома.
Кроме того, структура кристаллической решетки вещества также влияет на атомный радиус щелочноземельных металлов. Например, металлы с кубической решеткой имеют больший размер атома, чем металлы с гексагональной или кромецентрированной решеткой.
Интересно отметить, что атомный радиус щелочноземельных металлов уменьшается при ионизации, то есть при удалении одного или нескольких электронов из атома. Это связано с уменьшением отталкивающих электронных пар и сжатием атома в ионе.
Влияние атомного размера на свойства металлов
Атомный размер щелочноземельных металлов играет важную роль в определении их свойств. Размер атома влияет на их химическую активность, механические и электронные свойства.
Щелочноземельные металлы имеют большой атомный радиус, что делает их сравнительно мягкими и легкоплавкими. Это связано с возможностью перемещения атомов в кристаллической решетке и образованием слабых межатомных связей.
Большой атомный размер также способствует образованию слабых межатомных связей с окружающими атомами, что делает щелочноземельные металлы очень реактивными. Например, они реагируют с водой или кислородом из воздуха, образуя основания и оксиды соответственно.
Свойства металлов щелочноземельных металлов также зависят от их атомного размера. Например, увеличение атомного размера позволяет усиливать электронную проводимость и теплопроводность, а также снижать температуру плавления и плотность металлов.
Важно отметить, что атомный размер щелочноземельных металлов может варьироваться в зависимости от состояния (газообразного, жидкого или твердого) и окружающей среды. Это позволяет регулировать и контролировать их свойства для различных приложений в различных отраслях науки и техники.
Значение атомного радиуса в химических реакциях

Атомный радиус щелочноземельных металлов играет важную роль в химических реакциях. Этот параметр определяет размер атома, его распределение электронной оболочки и, следовательно, его химические свойства.
Во-первых, значение атомного радиуса щелочноземельных металлов влияет на их активность в химических реакциях. Чем меньше атомный радиус, тем сильнее энергия связи между атомом металла и другими атомами или ионами. Это означает, что металл будет более активным и будет склонен образовывать химические соединения с другими элементами.
Во-вторых, значение атомного радиуса также определяет взаимодействие между атомами щелочноземельных металлов в реакциях. Если атомы имеют большой радиус, они могут образовывать протонные ионные связи. Если атомы имеют малый радиус, они могут образовывать ковалентные связи. Эти различия в связи могут привести к различным видам химических реакций.
Кроме того, значение атомного радиуса щелочноземельных металлов влияет на их реакционную способность и скорость реакций. Чем больше радиус, тем меньше энергия, необходимая для реакции. Это означает, что металл может быстрее взаимодействовать с другими реагентами и образовывать продукты реакции.
В целом, значение атомного радиуса щелочноземельных металлов является важным параметром, определяющим их химические свойства и реакционную способность. Этот параметр позволяет предсказывать и объяснять поведение элементов в различных химических реакциях.
Атомный радиус в периодической таблице
Атомный радиус - это характеристика атома, которая показывает его размер. Он является одним из важных параметров, определяющих свойства химических элементов.
В периодической таблице атомный радиус может меняться в зависимости от положения элемента в периоде и группе. Обычно он увеличивается по мере движения от верхних левых углов к нижним правым.
В первом периоде таблицы находятся водород и гелий. Атомный радиус водорода составляет около 53 пикометров, в то время как радиус гелия равен примерно 31 пикометру. Это связано с увеличением количества электронных оболочек и ядерного заряда при движении по периоду.
Во втором периоде находятся литий, бериллий, бор и так далее. Атомный радиус увеличивается при движении слева направо, но уменьшается при движении сверху вниз. Например, атомный радиус лития составляет около 167 пикометров, а кальция - около 197 пикометров.
Таким образом, атомный радиус является важным свойством элементов в периодической таблице. Он определяет их размер и может влиять на их химические и физические свойства.
Экспериментальное определение атомного радиуса

Определение атомного радиуса щелочноземельных металлов осуществляется экспериментальным путем с использованием различных методов и приборов. Для этого проводятся различные измерения и наблюдения, включая рентгеноструктурный анализ, спектроскопию и другие методы. Эксперименты позволяют получить данные о размерах атомной структуры металла и о расстоянии между атомами.
Одним из наиболее распространенных методов определения атомного радиуса является рентгеноструктурный анализ. При этом использование рентгеновского излучения позволяет получить информацию о распределении электронной плотности вокруг атомного ядра. По полученным данным можно определить атомный радиус, а также другие характеристики структуры материала.
Другим методом, который применяется для определения атомного радиуса щелочноземельных металлов, является метод расщепления спектральных линий. Спектроскопические измерения позволяют определить разницу в энергиях уровней электронной оболочки атома, что связано с размерами атома и его электронной структурой. По полученным данным можно сделать выводы о радиусе атома металла.
Экспериментальное определение атомного радиуса щелочноземельных металлов является важным шагом в исследовании и понимании их структуры и свойств. Полученные данные могут быть использованы в различных областях, таких как материаловедение, химия и физика. Они помогают лучше понять свойства и поведение этих металлов, а также сделать прогнозы о их возможных применениях и взаимодействии с другими веществами.
Вопрос-ответ

Какие элементы относятся к щелочноземельным металлам?
К щелочноземельным металлам относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Зачем изучать атомный радиус щелочноземельных металлов?
Изучение атомного радиуса щелочноземельных металлов позволяет более полно понять их физические и химические свойства, а также влияние атомных размеров на взаимодействие с другими элементами и соединениями.
Какие значения атомных радиусов имеют щелочноземельные металлы?
Атомные радиусы щелочноземельных металлов увеличиваются с увеличением атомного номера элемента: бериллий имеет меньший радиус, чем магний, магний – меньший, чем кальций, и т.д. При этом радиусы щелочноземельных металлов обычно больше радиусов простых металлов, таких как натрий и калий, но меньше радиусов элементов из группы переходных металлов. Например, атомный радиус кальция составляет около 197 пикометров (1 пм = 10^-12 м).
