Электронная конфигурация является основой для понимания химических свойств и взаимодействий атомов и молекул. Она представляет собой распределение электронов по энергетическим уровням и орбиталям атома. Каждый элемент имеет свою уникальную электронную конфигурацию, которая определяет его проявление в химических реакциях и его место в периодической таблице.
Электронная конфигурация внешнего уровня 4s2 1s1 соответствует щелочному металлу. Щелочные металлы находятся в первой группе периодической таблицы и включают в себя такие элементы, как литий (Li), натрий (Na), калий (K) и др. Они обладают низкой электроотрицательностью и химически реактивными свойствами.
Лишь один электрон на внешнем уровне, в случае 1s1, и два электрона на внешнем уровне, в случае 4s2, делают щелочные металлы очень активными химическими элементами. Они имеют тенденцию отдавать свои электроны и образовывать положительно заряженные ионы. Это объясняет, почему щелочные металлы способны реагировать с кислородом и водой, выделяя горючие газы и образуя щелочные растворы.
Электронная конфигурация 4s2 1s1 является характерной чертой щелочных металлов и определяет их химические свойства и реактивность. Это важное понимание помогает не только в изучении периодической системы элементов, но и в применении щелочных металлов в нашей повседневной жизни, например, в производстве батарей, а также в медицине и других областях.
Безымянный заголовок

Электронная конфигурация внешнего уровня 4s2 1s1 соответствует щелочному металлу. Щелочные металлы – это элементы, обладающие сильным металлическим блеском и низкой температурой плавления и кипения.
У щелочных металлов внешний электронный уровень представлен двумя электронами в s-подуровне и одним электроном в p-подуровне. Это делает их реактивными и способными к образованию ионов с положительным зарядом. Под влиянием внешних условий, щелочные металлы могут легко отдавать свое внешнее электронное число, что приводит к образованию положительно заряженных ионов.
Щелочные металлы активно сопряжены с другими элементами и включены во множество биохимических и физических процессов в природе. Они обладают высокой способностью к химическим реакциям, что позволяет использовать их в различных областях, таких как промышленность, медицина и энергетика.
Важно отметить, что внешний уровень 4s2 1s1 является основным в более сложных электронных конфигурациях щелочных металлов. Он определяет основные химические и физические свойства этих элементов. Благодаря своей реактивности и возможности образования ионов, щелочные металлы играют важную роль в химических реакциях и процессах, происходящих как в природе, так и в лаборатории.
Значение электронной конфигурации внешнего уровня 4s2 1s1 для щелочных металлов

Электронная конфигурация внешнего уровня 4s2 1s1 соответствует щелочным металлам, таким как литий, натрий и калий. Эта конфигурация означает, что у атома такого металла на внешнем энергетическом уровне находятся два электрона. Они характеризуются высокими энергиями и легко участвуют в химических реакциях.
Электронная конфигурация внешнего уровня 4s2 1s1 является одним из ключевых свойств щелочных металлов. Она определяет их химическую активность и способность образовывать ионные соединения с другими элементами. Этот набор электронов на внешнем уровне делает щелочные металлы очень реактивными и подверженными окислению.
В связи с этим, щелочные металлы обладают свойствами, характерными для группы элементов, например, низкой электроотрицательностью и большой активностью в химических реакциях. Они образуют ионные соединения с элементами, имеющими более высокую электроотрицательность, такими как кислород или хлор. Такие соединения обладают солевыми свойствами и широко используются в различных сферах нашей жизни.
Кроме того, электронная конфигурация внешнего уровня 4s2 1s1 также влияет на физические свойства щелочных металлов. Самым явным примером является их мягкость и низкая плотность, что делает их очень легкими для обработки. Также щелочные металлы обладают хорошей теплопроводностью и электропроводностью, что делает их важными компонентами в различных технологических процессах.
Объяснение внешнего уровня

Электронная конфигурация внешнего уровня 4s2 1s1 соответствует щелочному металлу, так как имеет один электрон в внешней оболочке и два электрона в подуровне 4s. Внешний уровень электронной оболочки - это оболочка, на которой находятся электроны, участвующие в химических реакциях и взаимодействии с другими элементами.
Щелочные металлы находятся в первой группе периодической системы элементов и имеют сходную электронную конфигурацию на внешнем уровне. Внешний уровень у этих металлов содержит один электрон, что делает их очень реактивными. Эти элементы легко отдают свой внешний электрон, образуя положительный ион, чтобы достичь стабильной октаэдрической конфигурации.
Внешний электрон в щелочных металлах легко участвует в химических реакциях, образуя ионы с отрицательными зарядами при взаимодействии с элементами, которые имеют потребность в одном электроне для достижения стабильной октаэдрической конфигурации внешнего уровня.
Соответствие щелочному металлу

Электронная конфигурация внешнего уровня 4s2 1s1 соответствует одному из классов химических элементов - щелочным металлам. Щелочные металлы находятся в первой группе периодической таблицы Менделеева и включают в себя элементы литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой реактивностью и являются одними из самых активных химических элементов.
Электронная конфигурация 4s2 1s1 характерна для щелочных металлов, так как на внешнем энергетическом уровне такие элементы имеют две электроны в субуровне s. Данный электронный состав определяет их химические свойства, такие как способность образовывать положительные ионы с однозарядным положительным зарядом.
Щелочные металлы являются мягкими и легкими металлами, которые активно реагируют с водой, выделяя водород и образуя щелочные растворы. Они также образуют стабильные соединения с галогенами, образуя соли. Щелочные металлы широко используются в различных областях, таких как производство щелочных батарей, луговые процессы, косметическая и фармацевтическая промышленность, а также в производстве сплавов и стекла.
В заключение, электронная конфигурация 4s2 1s1 соответствует щелочным металлам, которые характеризуются высокой реактивностью и способностью образовывать положительные ионы с однозарядным положительным зарядом. Они обладают множеством применений и являются важными элементами в химической промышленности и научных исследованиях.
Роль 4s2 на внешнем уровне
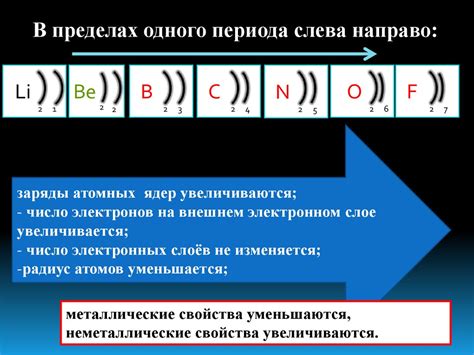
На внешнем электронном уровне атома элементов, имеющих электронную конфигурацию 4s2 1s1, находятся два электрона. Это относится к группе щелочных металлов в периодической системе элементов.
4s2 на внешнем уровне играет важную роль в образовании соединений и химических реакциях, которые характерны для щелочных металлов. В результате ущерба или добавления электронов на внешний электронный уровень, элементы с электронной конфигурацией 4s2 1s1 могут образовать позитивные или отрицательные ионы и вступать в реакции с другими элементами.
Электроны на внешнем уровне щелочных металлов, включая электроны 4s2 1s1, обладают низкой энергией и могут легко участвовать в химических реакциях. Это делает щелочные металлы реактивными и способными образовывать стабильные соединения с другими элементами.
4s2 на внешнем уровне также определяет некоторые особенности щелочных металлов. Например, они обладают низкой плотностью и низкой температурой плавления, что обусловлено их электронной конфигурацией на внешнем электронном уровне.
В целом, электронная конфигурация 4s2 1s1 щелочных металлов имеет ключевое значение для их химических свойств и способности образовывать соединения, что делает их важными элементами во многих отраслях науки и промышленности.
Значение 1s1 в электронной конфигурации
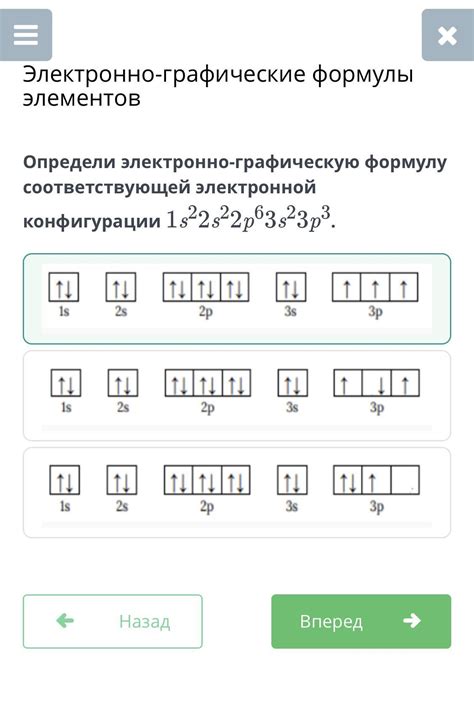
Электронная конфигурация атома описывает распределение его электронов по энергетическим уровням и орбиталям. Значение 1s1 в электронной конфигурации указывает на наличие одного электрона на первом энергетическом уровне в s-орбитали.
Первое число в значении (1s) обозначает номер энергетического уровня, а буква s обозначает s-орбиталь, которая является сферической и имеет форму шара. Таким образом, число 1s означает, что электрон находится на самом ближайшем к ядру энергетическом уровне и находится в s-орбитали.
Цифра 1 после литеры s указывает на наличие одного электрона в данной орбитали. Таким образом, в электронной конфигурации 4s2 1s1 указывается, что атом имеет 2 электрона на четвертом энергетическом уровне в s-орбиталях, и один электрон на первом энергетическом уровне в s-орбитали.
Значение 1s1 в электронной конфигурации соответствует щелочному металлу, так как щелочные металлы имеют один электрон на внешнем энергетическом уровне и характеризуются высокой реактивностью и способностью образовывать ионное связи. Это свойство обусловлено нестабильностью одного электрона на внешнем уровне и стремлением щелочных металлов достигнуть электронной конфигурации благородного газа путем передачи или приема этого электрона.
Особенности щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют ряд особенностей, которые делают их уникальными в периодической системе элементов.
Первая особенность щелочных металлов заключается в том, что они имеют одну электрон во внешней электронной оболочке, что делает их очень реактивными. Это означает, что они легко взаимодействуют с другими веществами, особенно с водой, в результате чего образуют щелочные растворы.
Второй особенностью щелочных металлов является их низкая плотность, что делает их легкими и хорошо плавучими на воде. Например, кусок лития, самого легкого щелочного металла, может даже плавать на поверхности воды.
Третья особенность связана с их способностью к образованию ионов с положительным зарядом. Щелочные металлы легко отдают свой единственный электрон, образуя катионы, что делает их хорошими проводниками электричества.
Четвертая особенность щелочных металлов заключается в их реактивности с кислородом. Они легко соединяются с кислородом, образуя оксиды, и, в наличии влаги, гидроксиды. Поэтому они должны храниться в специальных условиях, чтобы предотвратить их окисление и взрывоопасность.
Интересно отметить, что щелочные металлы играют важную роль в нашей повседневной жизни. Например, натрий используется в производстве стекла и мыла, калий широко применяется в удобрениях, а литий используется в производстве аккумуляторов и лекарственных препаратов.
Взаимодействие внешнего уровня с окружающей средой

Электронная конфигурация внешнего уровня 4s2 1s1 соответствует элементам группы щелочных металлов. Взаимодействие этих элементов с окружающей средой имеет особенности, определяющие их химические свойства и поведение.
Щелочные металлы характеризуются высокой реактивностью и активностью, так как внешний уровень электронной конфигурации содержит всего один или два электрона. Это обусловлено тем, что эти элементы стремятся достичь стабильной электронной конфигурации с полностью заполненным внешним уровнем электронов.
Взаимодействие щелочных металлов с окружающей средой происходит посредством химических реакций, в которых эти элементы отдают свой внешний электрон и образуют ионы положительного заряда. В результате таких реакций щелочные металлы образуют соли и газы, а также проявляют высокую способность к образованию комплексных соединений.
Вода является одним из наиболее активных средств взаимодействия щелочных металлов с окружающей средой. При контакте со щелочными металлами, вода претерпевает глубокие химические изменения, возникает химическая реакция, в результате которой образуется водород газ и щелочное растворение, состоящее из гидроксидных ионов.
Также щелочные металлы могут прямо реагировать с кислородом воздуха, образуя оксиды металлов или пероксиды. Некоторые щелочные металлы могут быть воспламенены при контакте с воздухом или водой.
Вопрос-ответ

Какая электронная конфигурация соответствует щелочным металлам?
Электронная конфигурация внешнего уровня щелочных металлов, таких как литий, натрий, калий, состоит из одного электрона в s-орбитали. Например, натрий имеет электронную конфигурацию 1s2 2s2 2p6 3s1, где 3s1 соответствует внешнему электрону, который может быть легко потерян.
Почему электронная конфигурация 4s2 1s1 соответствует щелочным металлам?
Электронная конфигурация 4s2 1s1 соответствует щелочным металлам, потому что они имеют похожую структуру внешних электронных оболочек. Эта конфигурация означает, что у атома есть два электрона на 4s-орбитали и один электрон на 1s-орбитали. Щелочные металлы характеризуются тем, что они имеют легкую склонность отдавать один свой электрон, чтобы достичь стабильной конфигурации с полной внешней оболочкой. Это делает их очень реактивными и способными образовывать ионные соединения с другими элементами.
Почему щелочные металлы имеют легкую склонность отдать свой внешний электрон?
Щелочные металлы имеют легкую склонность отдать свой внешний электрон из-за особенностей их электронной конфигурации. Внешний электрон на s-орбитали находится далеко от положительно заряженного ядра и слабо притягивается к нему. Поэтому при взаимодействии с другими элементами он легко отдается, чтобы образовать положительно заряженный ион. Это делает щелочные металлы хорошими источниками электронов в химических реакциях и обуславливает их высокую реактивность.
