Химические реакции играют важную роль во многих аспектах нашей жизни. Одной из таких реакций является сгорание порошка металла. В этой статье мы рассмотрим механизм образования оксида при сгорании металлического порошка и изучим его химические свойства.
Сгорание порошка металла является экзотермической реакцией, то есть происходит с выделением тепла. При сгорании металлического порошка в воздухе происходит реакция между металлом и кислородом. В результате этой реакции образуется оксид металла.
Механизм образования оксида при сгорании порошка металла заключается в следующих этапах. Сначала металлические частицы нагреваются до очень высокой температуры. Под действием высокой температуры происходит окисление металла путем реакции с кислородом из воздуха. Образующийся оксид металла может иметь различные свойства в зависимости от металла, который сгорает.
Химический состав и свойства оксида могут быть изменены путем добавления различных примесей или регулирования условий сгорания. Например, добавление алюминия к порошку металла может привести к образованию оксида алюминия, который обладает кислотными свойствами и широко используется в промышленности и научных исследованиях. Образование оксида при сгорании порошка металла представляет собой важный процесс, который находит применение в различных областях, включая производство и научные исследования.
Природа химических реакций

Химическая реакция - это процесс, при котором происходят изменения в химическом составе вещества. Она может протекать при взаимодействии между различными химическими веществами, при изменении условий окружающей среды или под воздействием внешней энергии.
Основой химической реакции является образование и разрушение химических связей между атомами вещества. В процессе реакции происходит перераспределение электронов между атомами, что приводит к изменению их расположения в молекуле и образованию новых соединений.
Природа химических реакций определяется рядом факторов, включая состав реагентов, структуру и свойства их молекул, температуру, давление, концентрацию и фазовое состояние вещества.
Скорость прохождения реакции зависит от активности реагентов, их концентрации и температуры. Некоторые реакции проходят очень медленно и могут занимать множество лет, в то время как другие могут происходить мгновенно.
Химические реакции можно разделить на различные классы в зависимости от типа превращений, например, окислительно-восстановительные реакции, кислотно-щелочные реакции, реакции синтеза и разложения и др. Каждый класс реакций имеет свои особенности и характерные признаки.
Оксиды: основные понятия

Оксиды – это химические соединения, образующиеся при реакции металла или неметалла с кислородом. Они представляют собой соли кислородной кислоты, в которых кислородный атом соединяется с элементом, образуя ион окиси.
Оксиды обладают разнообразными свойствами и имеют широкое применение в промышленности и повседневной жизни. Некоторые из них являются сильными окислителями, способными вызывать воспламенение или реагировать с другими веществами. Другие оксиды используются в качестве катализаторов или стабилизаторов в процессах синтеза и обработки материалов.
Оксиды могут быть разделены на несколько групп в зависимости от их состава и свойств:
- Металлические оксиды – соединения металлов с кислородом, которые обычно обладают высокой степенью твердости и температурой плавления.
- Неметаллические оксиды – соединения неметаллов с кислородом, которые могут быть как твердыми, так и газообразными веществами.
- Амфотерные оксиды – соединения, которые могут реагировать как с кислотами, так и с щелочами. Они обладают сразу двумя видами химической активности.
- Полезные оксиды – оксиды, используемые в производстве различных материалов и соединений, например, оксид железа Fe2O3 применяется как пигмент в красках и косметике.
Оксиды играют важную роль в химических реакциях и процессах, происходящих в природе и в технологических процессах. Изучение химических свойств оксидов помогает понять их влияние на окружающую среду и на различные системы.
Сгорание порошка металла: явление и условия

Сгорание порошка металла представляет собой химическую реакцию, при которой металл окисляется при взаимодействии с кислородом воздуха. Это явление сопровождается выделением энергии в виде тепла и света.
Для того чтобы порошок металла начал гореть, необходимо создать определенные условия. Во-первых, наличие кислорода воздуха является неотъемлемым условием для сгорания металла. В том случае, если воздуха недостаточно или его нет вовсе, сгорание не произойдет.
Во-вторых, порошок металла должен находиться в определенной температурной зоне, которая зависит от характеристик металла. Некоторые металлы, такие как алюминий или железо, начинают гореть при относительно низкой температуре, в то время как другие требуют высоких температур для сгорания.
Также важно отметить, что сгорание порошка металла может происходить только в атмосфере, где есть кислород. В вакууме или при отсутствии кислорода сгорание не возможно.
Взаимодействие кислорода и металла при сгорании
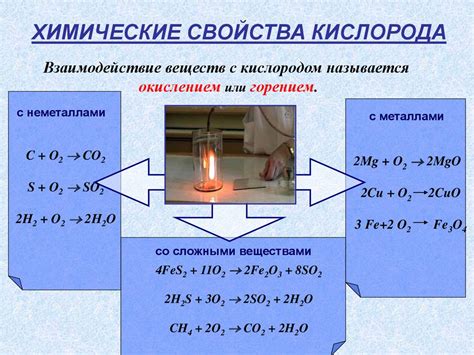
Сгорание порошка металла - это химическая реакция, при которой металл взаимодействует с кислородом из воздуха, образуя оксид металла. Этот процесс может происходить при высокой температуре или при воздействии искры или пламени. В результате этого взаимодействия, между металлом и кислородом происходит обмен электронами.
Образование оксида металла является результатом окисления металла, то есть добавления к нему кислорода. Оксид, возникающий в результате сгорания металла, обычно обладает различными свойствами - он может быть твердым, жидким или газообразным веществом.
Причиной сгорания металла может быть высокая температура, которая стимулирует химическую реакцию между металлом и кислородом. Также важно отметить, что это взаимодействие может происходить только в присутствии кислорода, поэтому оно обычно происходит на открытом воздухе или в кислородной среде.
Сгорание металла и образование оксида являются необратимыми процессами, то есть оксид металла нельзя просто превратить обратно в исходный металл путем удаления кислорода. Образование оксида - это новое вещество, обладающее уникальными свойствами и составом.
Образование оксида: процесс и свойства

Образование оксида является одной из важнейших химических реакций, которая происходит при сгорании порошка металла. Этот процесс сопровождается выделением тепла и света, а также изменением свойств и состава веществ.
Сгорание порошка металла происходит при воздействии на него кислорода из воздуха. Это вызывает окисление металла, при котором образуется оксид. Оксид представляет собой химическое соединение металла с кислородом. Образование оксида происходит с выделением энергии, что приводит к яркому свечению и высокой температуре пламени.
Свойства оксида зависят от свойств металла, с которым он образует соединение. Некоторые оксиды являются высокотемпературными и термостойкими веществами, что делает их полезными в различных отраслях промышленности.
Оксиды имеют разнообразные физические и химические свойства, включая электропроводность, растворимость и кислотность. Например, оксиды некоторых металлов могут проявлять кислотные свойства, то есть реагировать с водой, образуя кислоты.
Образование оксида при сгорании порошка металла является важным и практически значимым процессом. Эта реакция используется в различных областях, таких как промышленность, энергетика и производство различных материалов. Понимание процесса образования оксида и изучение его свойств позволяют контролировать и оптимизировать данную реакцию в различных приложениях и улучшать производственные процессы.
Применение оксидов в жизни человека

1. Промышленность:
Оксиды широко используются в различных отраслях промышленности. Например, оксид алюминия (Al2O3) применяется в производстве керамики, стекла и абразивных материалов. Оксид цинка (ZnO) используется в производстве пигментов, солнцезащитных средств и косметики.
2. Медицина:
Некоторые оксиды имеют применение в медицине. Например, оксид циркония (ZrO2) используется в стоматологии для изготовления имплантатов и коронок. Оксид железа (Fe2O3) применяется для производства железосодержащих препаратов.
3. Электроника:
Многие оксиды используются в электронной промышленности. Например, оксид кремния (SiO2) применяется при изготовлении микросхем и интегральных схем. Оксид кобальта (CoO) используется в производстве магнитов.
4. Сельское хозяйство:
Оксиды также имеют применение в сельском хозяйстве. Например, оксид кальция (CaO) используется как известь для улучшения плодородия почвы. Оксид серы (SO2) применяется в качестве дезинфицирующего средства для обработки семян.
5. Строительство:
В строительстве оксиды широко используются как компоненты различных материалов. Например, оксид кальция (CaO) присутствует в цементе, а оксид алюминия (Al2O3) используется в производстве строительных блоков и кирпичей.
Таким образом, оксиды играют важную роль в различных сферах человеческой жизни, от промышленности до медицины и строительства. Они используются в производстве различных материалов, в технике и даже в сельском хозяйстве.
Вопрос-ответ

Что такое оксид металла?
Оксид металла - это химическое соединение, которое образуется при взаимодействии металла с кислородом. Многие металлы могут образовывать различные оксиды в зависимости от условий реакции.
Как происходит образование оксида при сгорании порошка металла?
При сгорании порошка металла происходит быстрая реакция металла с кислородом. Металл окисляется при взаимодействии с кислородом, что приводит к образованию оксида металла. Эта реакция сопровождается выделением тепла и света. Скорость реакции зависит от множества факторов, включая размер и форму порошка, температуру и наличие катализаторов.
Какова роль кислорода в образовании оксида металла?
Кислород играет роль окислителя в реакции образования оксида металла. Он отбирает электроны у металла, окисляя его, и сам при этом восстанавливается. Это приводит к образованию ионов металла и ионов кислорода, которые соединяются и образуют оксид металла.
