Сероводород (H2S) – это химическое соединение, состоящее из двух атомов водорода и одного атома серы. Этот газ имеет характерный запах гнили и является одним из самых ядовитых веществ на Земле.
Исторически сероводород классифицировали как неметалл, исходя из его высокой реактивности и свойств, похожих на хлор. Однако с течением времени ученые пришли к выводу, что сероводород имеет металлические свойства.
Помимо своей ядовитости, сероводород обладает множеством других уникальных свойств. Он является газообразным при комнатной температуре и давлении. При охлаждении он может переходить в жидкое состояние. Сероводород также легко растворяется в воде, образуя серную кислоту.
Хотя сероводород может быть классифицирован и как металл, и как неметалл, он не является типичным представителем ни одной из этих групп. Его характеристики до сих пор вызывают споры среди ученых, и дальнейшие исследования помогут лучше понять природу этого уникального соединения.
Сероводород: свойства и классификация

Сероводород (H2S) - химическое соединение простого вещества серы с водородом. Он является одним из самых распространенных сероводородных соединений и обладает значительным интересом в научных и промышленных целях.
Сероводород - безцветный газ с запахом гнилой яйцы. Он имеет легкую летучесть и является токсичным в больших концентрациях. Сероводород обладает множеством свойств, которые определяют его уникальность и использование в различных отраслях.
С точки зрения классификации сероводород относится к группе неметаллов. Он обычно рассматривается как неметаллический элемент из-за своего воздушного состояния и химической активности.
Сероводород образуется в результате разложения органического материала, такого как серный белок, гниение яиц и другие процессы, которые происходят в природе и в промышленных условиях. Он также используется в различных отраслях, включая производство промышленных химикатов, нефтяная и газовая промышленность, а также в медицине.
Сероводород как элемент
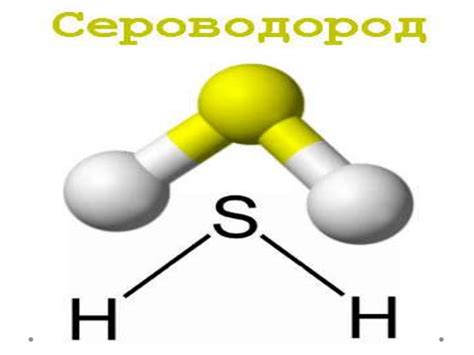
Сероводоро́д (H2S) является химическим элементом, который имеет ряд особенностей и свойств. Он относится к группе галогенов и обладает атомным номером 16 в периодической системе элементов.
Сероводород является неметаллом и характеризуется наличием двух атомов в своей молекуле. Несмотря на это, в некоторых условиях он может проявлять свойства металла, например, обладать электропроводностью в расплавленном или разряженном газообразном состоянии.
Элементарный сероводород обычно представляет собой газ, имеющий специфический запах, похожий на яйца. Он не имеет цвета, но может приобрести голубоватый оттенок при высоких концентрациях или низких температурах.
Сероводород является токсичным веществом и может быть опасным для живых организмов. Однако он также используется в различных отраслях промышленности, таких как химическая, нефтегазовая и металлургическая, в качестве сырья или промежуточного продукта для производства различных химических соединений.
Характеристики сероводорода

Сероводород (H2S) – химическое соединение, состоящее из двух атомов водорода и одного атома серы. Он обладает характеристиками как металла, так и неметалла.
Физические свойства сероводорода включают его газообразное состояние при комнатной температуре и давлении. Он образует безцветный газ с характерным запахом гниющего яйца, который можно легко распознать. Сероводород имеет плотность меньше воздуха и является легким газом.
Химические свойства сероводорода также интересны. Он является неполярным молекулой и может быть растворен в воде или органических растворителях. В растворенном состоянии сероводород образует слабую кислоту, что делает его реактивным взаимодействующим веществом.
Сероводород имеет высокий токсичный эффект, даже при низких концентрациях в воздухе. Он может вызывать серьезные проблемы со здоровьем, включая раздражение глаз, потерю сознания и даже смерть при высоких концентрациях в необеспеченных вентиляцией помещениях. Обратите особое внимание на правила безопасности при работе с сероводородом.
Сероводород в химических реакциях

Сероводород (H2S) — безцветный газ со специфическим запахом, присутствующий в различных химических реакциях. Он проявляет свои химические свойства, образуя соединения с различными элементами и соединениями.
Один из ключевых процессов, в которых участвует сероводород, это окисление в присутствии кислорода. При этом образуются сероводородные кислоты, такие как сероводородная кислота (H2SO4). Такие реакции часто применяются в производстве различных химических соединений, включая удобрения и красители.
Сероводород также проявляет активность при взаимодействии с металлами. Например, в реакции с железом образуется темно-серая сульфидная пленка на поверхности металла. Эта пленка является защитным слоем, который предотвращает окисление железа.
Другой интересной химической реакцией с участием сероводорода является его взаимодействие с некоторыми неорганическими и органическими соединениями. Например, сероводород может присоединяться к двойной связи в органических молекулах, образуя соединения сульфидов. Это важный процесс в органической химии, который позволяет проводить синтез различных органических соединений.
Таким образом, сероводород проявляет свои химические свойства в различных реакциях, играя важную роль в многих процессах и производствах. Его способность образовывать соединения с разными элементами и соединениями делает его важным и интересным объектом изучения для химиков и научных исследований.
Сероводород: свойства металла

Сероводород является неметаллическим химическим элементом, однако некоторые его свойства напоминают свойства металлов.
Во-первых, сероводород обладает проводимостью электричества. Это связано с его структурой, в которой электроны могут свободно двигаться и проводить электрический ток.
Во-вторых, сероводород имеет способность катионного присоединения и образованию солей, что характерно для металлов. Например, сероводород может образовывать сульфиды металлов, которые обладают своеобразными металлическими свойствами.
Кроме того, сероводород может образовывать стабильные соединения с металлами, так называемые металлические соединения. Эти соединения отличаются высокой стабильностью и способностью к образованию кристаллических сеток, что также является признаком металлов.
Однако, несмотря на некоторые свойства металлов, сероводород все же не является металлом. Он принадлежит к группе неметаллов, так как имеет низкую температуру плавления и кипения, а также не обладает металлическим блеском и прочностью.
Сероводород: кислотность или щелочность?

Сероводород (H2S) - химическое соединение, состоящее из двух атомов водорода и одного атома серы. Он является безцветным газом с характерным запахом гнилой яиц. В зависимости от условий, сероводород может выступать как кислота, так и щелочь.
Когда сероводород растворяется в воде, он образует водную кислоту, которая известна как сероводородная кислота. Эта кислота обладает свойствами кислоты – она может отдавать протоны и образовывать соли. Кислотная форма сероводорода обусловлена наличием заряженных ионов в растворе, которые могут проявлять кислотные свойства.
Однако сероводород также может образовывать щелочные растворы в сильно основных условиях. В результате взаимодействия сероводорода с щелочами образуются гидросульфиды – соли сероводородной кислоты. В таких растворах сероводород может отхватывать протоны и проявлять щелочные свойства.
Сероводород может быть кислотой или щелочью в зависимости от pH раствора, в который он вступает. Если pH раствора ниже 7, сероводород будет проявлять кислотные свойства, а если pH выше 7, то он проявит щелочные свойства. Важно отметить, что в нейтральных условиях, сероводород не будет проявлять ни кислотные, ни щелочные свойства.
Сероводород в природных процессах

Сероводород (H2S) — газообразное вещество, безцветный и резкий по запаху. Он широко распространен в природе и играет важную роль в различных природных процессах.
В первую очередь, сероводород образуется в результате разложения органического вещества, такого как растительные остатки и протеины, в отсутствие кислорода. Такой процесс называется анаэробным разложением. Например, это может происходить в грязи на дне пресных и морских водоемов, а также в подземных водах. Как правило, сероводород образуется в условиях низкой температуры и высокого давления в глубинных слоях почвы и седиментарных породах.
Сероводород также является продуктом активности некоторых микроорганизмов. Например, сероводород производится специальными бактериями в процессе анаэробного дыхания. Они используют сероводород в качестве энергетического источника или для обеспечения процессов обмена веществ.
Одной из наиболее известных природных проявлений сероводорода являются так называемые сероводородные источники, или гейзеры. Подземные источники гейзеров содержат воду, насыщенную сероводородом, который при выходе на поверхность реагирует с кислородом воздуха и образует желто-зеленые отложения серы. Также сероводородные источники часто сопровождаются выбросом вулканического газа и пара.
В заключение, сероводород играет важную роль в многих природных процессах, включая разложение органического материала, энергетический метаболизм микроорганизмов и формирование гейзеров. Он представляет собой важный элемент природного круговорота и неотъемлемую часть экосистемы.
Вопрос-ответ

В каких условиях сероводород может проявлять металлические свойства?
Сероводород в металлической форме может проявлять свойства металла при очень высоких давлениях и низких температурах, сходных с условиями внутри планет. В этих экстремальных условиях, сероводород может образовывать металлические цепочки, подобные металлическим связям в металлах.
Как сероводород проявляет свои неметаллические свойства?
Сероводород обычно проявляет неметаллические свойства при нормальных условиях температуры и давления. Он является химическим элементом из группы неметаллов в периодической системе и обладает характерными неметаллическими свойствами, такими как непроводимость электричества и тепла, хрупкость и низкая плотность.
Какие свойства сероводорода позволяют считать его металлом?
Сероводород редко проявляет металлические свойства в обычных условиях, но при очень высоких давлениях (более 1,5 миллиона атмосфер) и низких температурах (порядка -70 градусов по Цельсию), он может образовывать металлические цепочки, которые проявляют металлическую проводимость электричества и тепла и обладают другими металлическими свойствами.
Каковы основные свойства сероводорода как неметалла?
Основные свойства сероводорода, указывающие на его неметаллический характер, включают непроводимость электричества и тепла, хрупкость, низкую плотность, способность образовывать ковалентные связи с другими элементами и молекулами, а также низкую температуру кипения и плавления.
Какие примеры можно привести для наглядного сравнения свойств сероводорода как металла и неметалла?
Для наглядного сравнения свойств сероводорода как металла и неметалла можно привести следующие примеры: в металлической форме сероводород будет проводить электричество и тепло, обладать металлическим блеском и совершать деформации под воздействием силы. В неметаллической форме сероводород будет не проводить электричество и тепло, обладать хрупкостью и не иметь металлического блеска.
