Серная кислота (H2SO4) – это сильная кислота, которая широко используется в различных процессах и промышленности. Она имеет важное значение в химии и является одной из наиболее распространенных кислот в нашей жизни. Металлические оксиды являются соединениями, состоящими из металлических и кислородных атомов. Когда серная кислота вступает во взаимодействие с металлическими оксидами, образуется ионное соединение.
Взаимодействие металлических оксидов с серной кислотой результативно благодаря тому, что серная кислота является сильным оксидирующим агентом. Она способна перекислять металлы и освобождать молекулярный кислород. А металлические оксиды, в свою очередь, обладают щелочными свойствами и могут реагировать с кислотами.
При взаимодействии металлических оксидов с серной кислотой происходит образование ионных соединений, в которых кислотный остаток (H+) присоединяется к оксиду, образуя катион, а кислородные атомы переходят находятся в состоянии аниона. Таким образом, в результате реакции серной кислоты с металлическими оксидами образуется соль и вода. Эта реакция является экзотермической и происходит с выделением тепла.
Свойства серной кислоты

Серная кислота (H2SO4) - одно из самых важных и распространенных химических веществ. Она обладает рядом уникальных свойств, которые делают ее неотъемлемой частью множества процессов и применений.
Прежде всего, серная кислота является сильным кислотным веществом. Она растворяется в воде, образуя ионные связи и обладая выраженными кислотными свойствами. Кроме того, она обладает деятельным окислительным действием, способна взаимодействовать с многими другими веществами.
Серная кислота характеризуется высокой концентрацией водных растворов и плотностью. Это позволяет ей быть эффективным средством для регулирования кислотности в различных производственных процессах.
Одно из важнейших свойств серной кислоты - ее сильная коррозионная активность. Она способна вызывать разрушение и повреждение различных материалов, включая металлы и металлические оксиды. Это свойство находит применение в различных отраслях промышленности, например, при удалении коррозии или очистке поверхностей от накипи и ржавчины.
Серная кислота также обладает высокой теплопроводностью и способностью выделять большое количество тепла при реакциях. Благодаря этим свойствам она применяется в термохимических процессах и производстве энергии.
В заключение, серная кислота - это важное химическое вещество, которое обладает рядом уникальных свойств. Ее кислотные, окислительные и коррозионные свойства нашли широкое применение в различных областях науки и промышленности.
Типы оксидов
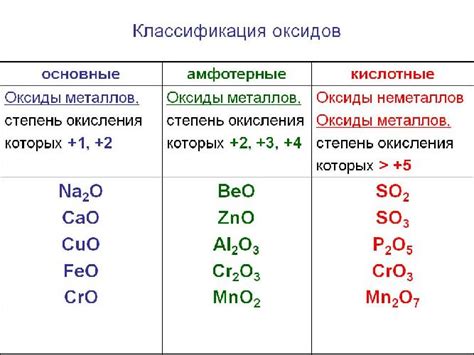
Оксиды - это химические соединения, которые образуются при взаимодействии металлов или неметаллов с кислородом. В зависимости от свойств и состава исходных элементов, оксиды могут быть разных типов.
1. Основные оксиды. Они образуются при взаимодействии металлов с кислородом. Такие оксиды растворяются в воде и образуют основания, то есть щелочные растворы. Примеры основных оксидов: калия оксид (К2О), натрия оксид (Na2О).
2. Кислотные оксиды. Эти оксиды образуются при взаимодействии неметаллов с кислородом. Они обладают кислотными свойствами и реагируют с водой, образуя кислоты. Примеры кислотных оксидов: углекислый газ (СО2), серный оксид (SO2).
3. Амфотерные оксиды. Эти оксиды обладают как кислотными, так и основными свойствами. Они реагируют как с кислотами, так и с основаниями. Примеры амфотерных оксидов: оксид алюминия (Al2O3), оксид цинка (ZnO).
4. Нейтральные оксиды. Это оксиды, которые не обладают ни кислотными, ни основными свойствами. Они не реагируют с водой. Примеры нейтральных оксидов: оксид углерода (СО), оксид азота (N2О).
Таким образом, оксиды делятся на несколько типов в зависимости от свойств и состава исходных элементов. Изучение этих типов оксидов позволяет понять их реакционную способность и применение в разных областях химии и промышленности.
Взаимодействие с металлическими оксидами

Металлические оксиды являются одними из важных соединений в химии. Взаимодействие серной кислоты с металлическими оксидами приводит к образованию ионных соединений, которые могут иметь различные свойства и применения.
Во время реакции серной кислоты с металлическими оксидами происходит образование солей серной кислоты. Например, взаимодействие серной кислоты с оксидом железа(II) приводит к образованию сульфата железа(II) и выделению воды.
Реакция между серной кислотой и металлическими оксидами имеет важные технические и промышленные применения. Например, сульфаты металлов, полученные в результате реакции, используются как сырье для производства удобрений, красителей и других химических продуктов.
Однако реакция серной кислоты с металлическими оксидами может быть сопровождена выделением тепла и образованием опасных пылевых веществ. Поэтому при работе с этими веществами необходимо соблюдать меры безопасности и использовать соответствующие средства защиты.
Формирование ионного соединения
Формирование ионного соединения может происходить при взаимодействии серной кислоты с металлическими оксидами. Серная кислота – одно из наиболее распространенных ионных соединений, имеющих множество применений в различных отраслях промышленности.
В процессе взаимодействия серной кислоты с металлическими оксидами происходит образование ионного комплекса. Оксиды металлов обладают основными свойствами и реагируют с кислотами, в результате чего образуется соль и вода. Как правило, процесс сопровождается выделением тепла и может протекать как в растворе, так и в твердой фазе.
Ионное соединение, образующееся при взаимодействии серной кислоты с металлическими оксидами, имеет ряд характеристик. Во-первых, образование ионного комплекса происходит путем передачи электронов между атомами веществ. В результате этого процесса образуются ионы положительного и отрицательного заряда, которые притягиваются друг к другу и образуют кристаллическую решетку.
Во-вторых, ионное соединение обладает высокой растворимостью в воде и образует электролитические растворы. Это связано с наличием ионов в решетке, которые способны проводить электрический ток. Поэтому растворы ионных соединений обладают электропроводностью.
Таким образом, формирование ионного соединения при взаимодействии серной кислоты с металлическими оксидами является важным процессом, который имеет практическое применение в различных областях науки и промышленности.
Реакция окисления

Одной из основных химических реакций, которые могут происходить при взаимодействии серной кислоты с металлическими оксидами, является реакция окисления. В данной реакции металлический оксид, содержащий в своей структуре кислород, окисляется под действием серной кислоты.
Реакция окисления представляет собой процесс передачи электронов от металлического оксида к серной кислоте. При этом металлический оксид переходит в более высокую степень окисления, а серная кислота восстанавливается, получая электроны от оксида.
В результате реакции окисления образуется новое вещество - солевой комплекс, который состоит из катиона металла и аниона серной кислоты. Солевой комплекс обладает устойчивой структурой и характерными свойствами, которые отличают его от исходных веществ.
Реакция окисления играет важную роль во многих химических процессах, таких как синтез новых веществ, электрохимические реакции, производство металлов и другие. Понимание механизма реакции окисления позволяет прогнозировать результаты химических превращений и эффективно использовать их в научных и технических целях.
Влияние pH раствора

Взаимодействие серной кислоты с металлическими оксидами зависит от pH раствора, то есть от его кислотности или щелочности. pH является мерой концентрации ионов водорода в растворе. Он может быть как кислотным (меньше 7), так и щелочным (больше 7).
При кислом pH раствора серная кислота действует на металлические оксиды, образуя с ними соли и воду. Происходит образование ионного соединения, при котором ионы металла вступают в реакцию с ионами серной кислоты, образуя соль. При этом в раствор выделяется вода.
В случае щелочного pH раствора взаимодействие металлических оксидов с серной кислотой идет иначе. Щелочная среда нейтрализует кислоту, образуя соль и воду. При этом образуются ионы, которые могут образовывать соли, но металлические оксиды, как правило, не вступают в реакцию с серной кислотой в щелочной среде. Вместо этого образуются гидроксиды металла и соли с кислотными основаниями.
Таким образом, pH раствора серной кислоты играет важную роль при взаимодействии с металлическими оксидами. Кислотная среда способствует образованию солей, а щелочная среда предпочитает образование гидроксидов металла и солей с кислотными основаниями.
Физические свойства раствора

Раствор серной кислоты обладает рядом физических свойств, которые определяют его внешний вид и способность взаимодействовать с окружающей средой.
Во-первых, раствор серной кислоты обладает высокой плотностью и вязкостью. Это связано с присутствием большого количества молекул серной кислоты в единице объема раствора. Высокая вязкость затрудняет перемешивание раствора и может оказывать влияние на скорость химических реакций, происходящих в растворе.
Во-вторых, раствор серной кислоты обладает кислотными свойствами, проявляющимися в рН ниже 7. Это связано с тем, что серная кислота является сильной кислотой и образует ионы водорода при диссоциации. Наличие ионов водорода делает раствор кислотным и способным проявлять реакции кислотного характера.
В-третьих, раствор серной кислоты обладает сильным раздражающим действием на кожу, слизистые и дыхательные пути. Это связано с высокой концентрацией серной кислоты и ее коррозивными свойствами. При контакте с раствором серной кислоты необходимо соблюдать меры предосторожности и использовать защитное снаряжение.
Итак, раствор серной кислоты обладает определенными физическими свойствами, которые определяют его характеристики и поведение при взаимодействии с другими веществами.
Взаимодействие с другими соединениями
Серная кислота является сильной кислотой и активно взаимодействует с различными соединениями. Взаимодействие с щелочами приводит к образованию соответствующих солей и выделению воды.
Сильные оксиды металлов, такие как оксиды натрия, кальция и магния, реагируют с серной кислотой, образуя соли и воду. Например, при взаимодействии серной кислоты с оксидом натрия образуется натриевая соль серной кислоты (натрийсульфат) и вода:
Na2O + H2SO4 → Na2SO4 + H2O
Серная кислота также реагирует с основными оксидами, например, оксидом алюминия. В результате взаимодействия образуется соль серной кислоты - алюминийсульфат, и выделяется вода:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Также серная кислота может реагировать с некоторыми соединениями, содержащими гидроксильные группы, например, с гидроксидом натрия. В этом случае образуется соль серной кислоты - натрийсульфат и выделяется вода:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Таким образом, серная кислота обладает широким спектром реакций с различными соединениями, что делает ее важным химическим веществом во многих промышленных и лабораторных процессах.
Применение в промышленности

Серная кислота является одним из самых важных химических соединений в промышленности. Она широко используется в различных отраслях, благодаря своим уникальным свойствам и высокой химической активности.
Одним из главных областей применения серной кислоты является производство удобрений. Серная кислота является неотъемлемым компонентом при производстве азотных удобрений, таких как аммиак и аммофос, которые являются основными компонентами многих видов удобрений.
Кроме того, серная кислота применяется также в процессе очистки металлов. Она используется для удаления окислов и примесей с поверхности металлических изделий, что позволяет повысить их качество и стойкость к коррозии.
Еще одним важным направлением использования серной кислоты является производство бумаги. Она применяется для делигнификации древесного сырья, что позволяет улучшить качество и устойчивость бумаги.
Помимо этого, серная кислота используется в химической промышленности для получения различных соединений, таких как сульфаты, сложные неорганические соли и комплексы, используемые в процессе производства пластмасс, пигментов, красителей, лаков и других химических продуктов.
Вопрос-ответ

Какое ионное соединение образуется при взаимодействии серной кислоты с оксидами металлов?
При взаимодействии серной кислоты с оксидами металлов образуется соответствующее сернокислое соль. Возникающая реакция можно представить следующим образом: SО3 + H2O → H2SO4. Таким образом, образуется серная кислота.
Какие металлические оксиды могут реагировать с серной кислотой?
Реакцию с серной кислотой могут провести различные металлические оксиды, такие как оксид алюминия, оксид меди, оксид железа и др. Реакция будет протекать по принципу образования соответствующего сернокислого солей.
Какие примеры ионных соединений можно привести в случае взаимодействия серной кислоты с металлическими оксидами?
Примеры ионных соединений, образующихся при взаимодействии серной кислоты с металлическими оксидами, это серная кислота с алюминием – Al2(SO4)3, серная кислота с медью – CuSO4, серная кислота с железом – Fe2(SO4)3 и т.д.
Как происходит реакция между серной кислотой и металлическими оксидами?
Реакция между серной кислотой и металлическими оксидами происходит с образованием соответствующей сернокислой соли и воды. При этом ион металла из оксида замещается водородным ионом из серной кислоты. Пример уравнения реакции: SО3 + H2O → H2SO4.
