Серебро - это металл, который давно известен человечеству и широко используется в различных отраслях. Часто его называют "белым золотом" из-за его яркого белого цвета и ценных свойств. Однако, при всей своей практичности, серебро обладает и некоторыми особенностями, которые поднимают вопрос о том, является ли оно действительно активным металлом.
В химии активными металлами называются элементы, которые легко вступают в реакции с другими веществами. Они способны активно взаимодействовать с водой, кислотами и щелочами, образуя соединения и выделяя газы. Каждый активный металл имеет свои особенности и приложения в различных сферах, от электроники до медицины.
Однако, серебро, несмотря на свою практичность и широкое использование, обладает меньшей активностью по сравнению с некоторыми другими металлами. Оно может взаимодействовать с некоторыми химическими веществами, но не настолько интенсивно, как, например, натрий или калий. В то же время, серебро обладает высоким проводящим и антибактериальным свойствами, что делает его незаменимым в многих областях, включая электротехнику, медицину и производство украшений.
Таким образом, можно сказать, что серебро, хотя и не является самым активным металлом, обладает своими уникальными химическими и физическими свойствами, делая его ценным и востребованным в различных сферах деятельности человека.
Химические свойства серебра

1. Устойчивость к окислению: Серебро обладает высокой химической инертностью и практически не окисляется на воздухе. Однако при наличии сернистых газов серебро может образовывать серебряную серу.
2. Взаимодействие с кислотами: Серебро реагирует с различными кислотами, образуя соответствующие соли. Например, при взаимодействии с нитратной кислотой образуется серебряный нитрат AgNO3, который широко используется в химической промышленности и лабораторной практике.
3. Взаимодействие с щелочами: Серебро может быть растворено в щелочах, таких как гидроксид натрия (NaOH) или гидроксид калия (KOH). При этом образуются соответствующие соли, например, серебряный оксид Ag2O или серебряный гидроксид AgOH.
4. Взаимодействие с халькогенами: Серебро легко взаимодействует с халькогенами – фтором (F), хлором (Cl), бромом (Br) и йодом (I). При этом образуются хлорид AgCl, бромид AgBr и йодид AgI, которые обладают характерными цветами – соответственно белым, желтым и желтовато-коричневым.
5. Образование сплавов: Серебро может образовывать сплавы с другими металлами, такими как медь (Cu), золото (Au) и платина (Pt). Эти сплавы обладают уникальными физическими и химическими свойствами и находят широкое применение в различных областях промышленности.
6. Каталитическая активность: Серебро обладает высокой каталитической активностью и часто используется в различных химических реакциях. Например, серебровые катализаторы применяются в производстве ацетилена, водорода, формальдегида и других веществ.
Реакция серебра с кислородом и серной кислотой

Как активный металл, серебро имеет способность взаимодействовать с кислородом и серной кислотой, образуя различные соединения и проявляя реакционную активность.
При взаимодействии серебра с кислородом, образуется оксид серебра (Ag2O). Это реакция окисления, при которой один атом серебра совершает переход и соединяется с кислородом из воздуха. Оксид серебра обладает амфотерными свойствами и может взаимодействовать как с кислотами, так и с щелочами.
Если серебро взаимодействует с серной кислотой (H2SO4), то образуется серебряная соль - сернокислое серебро (Ag2SO4). Реакция происходит по типу обмена, при котором серебро вытесняет водород из молекулы серной кислоты. Сернокислое серебро является белым кристаллическим веществом и хорошо растворяется в воде.
Таким образом, реакция серебра с кислородом и серной кислотой подтверждает активность этого металла и его способность к активной химической переработке. Взаимодействие серебра с кислородом и серной кислотой является важным в химической промышленности и может использоваться для получения различных соединений серебра.
Взаимодействие серебра с хлорами

Серебро – активный металл, который проявляет высокую реактивность при взаимодействии с хлорами. Серебро легко соединяется с хлором, образуя хлорид серебра (AgCl).
Хлорид серебра является нерастворимым в воде соединением и образует белый осадок. Это явление можно наблюдать при растворении серебра или его соединений в растворе хлорида натрия или хлорида калия.
Серебро также обладает способностью образовывать соединения с другими хлорсодержащими веществами, такими как хлорид аммония или хлорид цинка. Полученные соединения могут иметь разные физические и химические свойства.
Взаимодействие серебра с хлорами применяется в различных областях, например, в химическом анализе для обнаружения присутствия хлора в образцах или в фармацевтической промышленности для получения препаратов на основе серебра.
Способность серебра к окислению и восстановлению
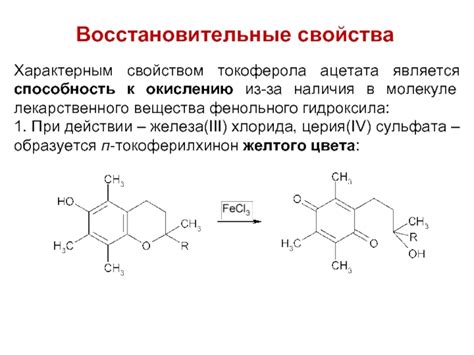
Серебро является активным металлом, проявляющим способность к окислению и восстановлению. Этот процесс связан с наличием свободных электронов в его атомной структуре.
При окислении серебра его атомы теряют один или несколько электронов и превращаются в положительно заряженные ионы. Это происходит при взаимодействии металла с кислородом, кислотами или другими окислителями. При этом образуются окислы серебра, которые могут иметь различную степень окисления.
С другой стороны, серебро обладает способностью к восстановлению, то есть возвращению потерянных электронов. Этот процесс происходит при взаимодействии серебра с веществами, способными передавать электроны. В результате серебро возвращается к своей исходной нейтральной форме, а вещество, служащее восстановителем, само окисляется.
Способность серебра к окислению и восстановлению находит применение в различных областях. Например, серебряные соли используются в фотографии, где серебро окисляется при экспонировании пленки или бумаги под воздействием света. В медицине серебро применяется в антимикробных препаратах, где его способность к окислению позволяет уничтожать микроорганизмы.
Таким образом, способность серебра к окислению и восстановлению является важной характеристикой этого металла, которая определяет его активность и применение в различных областях науки и промышленности.
Серебро как катализатор
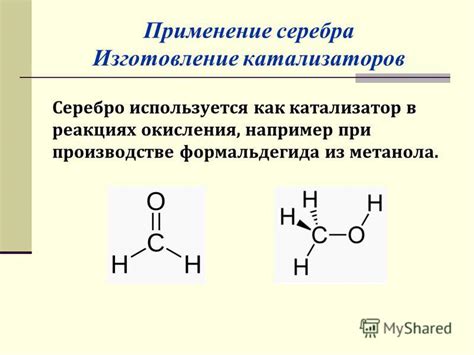
Серебро - один из самых эффективных катализаторов в химических реакциях. Благодаря своим уникальным свойствам, серебро позволяет увеличить скорость реакции и снизить температуру ее протекания.
Серебро обладает высокой каталитической активностью благодаря своей способности вступать в реакцию с другими веществами и ускорять их превращение. Особенно эффективно серебро действует в реакциях окисления, гидрирования и дезаминирования.
Каталитическое действие серебра связано с его электрохимическими свойствами. Активные центры серебра могут принимать или отдавать электроны, что позволяет участвовать в различных реакциях. Благодаря своей высокой электроотрицательности, серебро способно эффективно активировать молекулы веществ, ускоряя их превращение.
Серебро применяется в качестве катализатора в различных сферах промышленности, в том числе в производстве наркотиков, пластиков и фармацевтических препаратов. Оно также используется в очистке воды и воздуха от вредных примесей и предотвращении коррозии металлических поверхностей.
Использование серебра как катализатора имеет ряд преимуществ: более высокая эффективность, меньшее время реакции, возможность работы при низких температурах и в условиях низкого давления. Благодаря этим свойствам серебро остается одним из наиболее востребованных катализаторов в современной промышленности.
Серебро в электрохимии

Серебро относится к активным металлам, и его активность проявляется в различных реакциях в электрохимии. Однако, оно не является самым активным металлом, что объясняется его специфической реакционной способностью. Серебро обладает высокой электронной проводимостью и выдерживает агрессивные условия окружающей среды, что делает его полезным материалом в электрохимических процессах.
В электрохимии серебро широко используется в качестве электрода. Серебряные электроды широко применяются в гальванических элементах, аккумуляторах, электролизере и других устройствах для конвертации электрической энергии. Серебряный электрод считается стандартным, так как его потенциал относительно водорода равен нулю. Это значит, что потенциал серебра может служить эталоном для определения потенциалов других электродов.
Серебро также используется в электролизе, процессе разложения вещества с применением электрического тока. В процессе электролиза серебро может быть использовано как катодный или анодный материал, в зависимости от желаемой реакции. Например, при электролизе раствора серебряного нитрата, серебро служит катодом и осаждается на поверхности электрода.
Важно отметить, что серебро чувствительно к окислительно-восстановительным реакциям. При вступлении в реакцию с окислителем, серебро может окисляться, теряя электроны, а при вступлении в реакцию с восстановителем, серебро может восстанавливаться, получая электроны. Эти реакции в электрохимии могут быть использованы для различных целей, таких как получение и очистка серебра, электролиз и электроосаждение.
Вопрос-ответ

Существует ли активный металл серебро?
Да, серебро является активным металлом. Оно активно взаимодействует с водой и некоторыми кислотами, обладает высокой электропроводностью и химической устойчивостью.
Какие свойства делают серебро активным металлом?
Серебро активно реагирует с кислородом воздуха, образуя оксид серебра, который может быть легко восстановлен обратно в металл при воздействии различных веществ, например, водорода. Это свойство делает серебро активным металлом.
Почему серебро называют активным металлом?
Серебро называют активным металлом из-за его способности активно реагировать с другими веществами. Оно обладает высокой реакционной способностью, особенно при контакте с водой, кислотами и некоторыми галогенами. Это делает его активным и значимым в химических процессах.
Серебро - это активный металл или нет?
Да, серебро относится к активным металлам. Оно обладает хорошей проводимостью тепла и электричества, активно вступает в реакции с другими веществами и образует соединения, такие как оксид серебра. Эти свойства сделали серебро ценным металлом в различных областях, от электроники до медицины.
