Щелочные металлы - это химическая группа элементов, которая включает в себя литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе периодической таблицы и обладают сходными свойствами.
Одной из характеристик щелочных металлов является низкая плотность, что делает их легкими и хорошо плавающими на воде. Также они являются отличными проводниками электричества и тепла. Более того, щелочные металлы обладают высокой реактивностью и легко вступают в химические реакции с водой, кислородом и другими веществами.
Каждый элемент из семейства щелочных металлов имеет свои уникальные свойства. Например, литий отличается низкой плотностью и низкой температурой плавления, что делает его идеальным выбором для использования в аккумуляторах. Натрий используется в производстве жидкого стекла и щелочи, калий - в удобрениях, а рубидий и цезий находят применение в научных и исследовательских целях.
Природное вхождение щелочных металлов также разнообразно. Например, литий распространен в природе в виде специальных минералов, таких как лепидолит и пегматит. Натрий обычно находится в морской воде и некоторых минералах, таких как халит. Калий часто присутствует в почве и растительных остатках, а рубидий и цезий встречаются в минералах пегматитов и гранитов.
Что такое щелочные металлы?
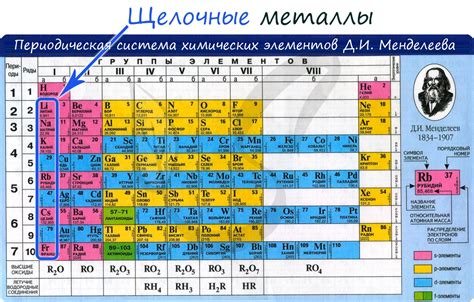
Щелочные металлы - это химические элементы из первой группы периодической таблицы, которые встречаются в природе только в соединениях. К этой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы имеют низкую плотность и низкую температуру плавления, они легко реагируют с водой и кислородом. Они обладают хорошей электропроводностью и используются в производстве батарей, сплавов и других электронных устройств.
Каждый щелочный металл имеет свои уникальные химические свойства. Например, литий является легким металлом с низкой плотностью, а калий обладает высокой химической активностью и способностью образовывать ярко-фиолетовые пламя.
Щелочные металлы широко применяются в различных отраслях промышленности и научных исследованиях. Они являются неотъемлемой частью нашей жизни и имеют множество практических применений.
Свойства щелочных металлов

Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются рядом химических и физических свойств.
Первое свойство, которое отличает щелочные металлы, это их низкая плотность. Например, литий является самым легким металлом, обладая плотностью всего 0,53 г/см³. Кроме того, они относительно мягкие: их мягкость можно ощутить простым нажатием ногтя.
Другой характеристикой щелочных металлов является их высокая реактивность. Они активно взаимодействуют с водой, выделяя водород и образуя щелочные гидроксиды. Они также реагируют с кислородом воздуха, быстро окисляясь.
Щелочные металлы обладают высокой электропроводностью и хорошей теплопроводностью. Они используются в различных электрохимических приборах, таких как батареи и аккумуляторы. Кроме того, они проявляют яркую окраску при нагревании, что делает их полезными в производстве пиротехнических изделий.
Некоторые щелочные металлы, такие как литий и калий, обладают также медицинскими свойствами. Литий используется для лечения некоторых психических расстройств, а калий является важным элементом для нормального функционирования организма.
Первый химический элемент щелочных металлов
Литий — первый химический элемент щелочных металлов, относящийся к первой группе периодической таблицы. Он имеет атомный номер 3 и обозначается символом Li. Литий был открыт в 1817 году шведским химиком Йоханом Аругведсоном.
Литий является легким щелочным металлом серебристо-белого цвета. Он является самым легким металлом и наименее плотным металлом после ртути и содиума. Литий обладает низкой температурой плавления и кипения, а также обладает высокой электропроводностью. При нормальных условиях он реагирует с водой, образуя литиевую щелочь и выделяя водород.
Литий широко используется в различных областях, включая электрохимию, металлургию, фармацевтику и аэрокосмическую промышленность. Он также используется в производстве легких и прочных сплавов, литий-ионных аккумуляторов, а также в керамике и стеклянной промышленности.
Природное вхождение лития относительно низкое. Его можно найти в минералах, таких как лепидолит, сподумен и петалит. Главные резервы лития находятся в Чили, Австралии, Китае и Аргентине. Добыча лития является важной отраслью в этих странах.
Второй элемент группы щелочных металлов

Вторым элементом группы щелочных металлов является литий, который обладает уникальными химическими свойствами. Подобно другим металлам этой группы, литий обладает низкой плотностью и мягкостью. Однако, по сравнению с другими щелочными металлами, литий является самым легким и наименее реактивным.
Литий является очень реактивным элементом, особенно при контакте с водой или кислородом. В результате реакции с водой, образуется щелочная среда, а также выделяется водород. В повседневной жизни литий используется в производстве аккумуляторов, так как обладает высокой электрохимической активностью. Также этот элемент находит применение в производстве лекарственных препаратов, стекла и керамики.
Литий является очень редким химическим элементом в земной коре и практически не встречается в чистом виде. Он преимущественно находится в минералах, таких как сподумеен и лепидолит. Литий также представлен в морских водах и геотермальных источниках. Его природное вхождение ограничено, что делает его дорогим и востребованным элементом.
Физические свойства щелочных металлов

Щелочные металлы - низкоплавкие элементы при комнатной температуре, которые легко плавятся и испаряются. Они обладают мягкостью и малой плотностью, что делает их легкими для обработки. Некоторые щелочные металлы, такие как литий и натрий, имеют низкую плотность и могут даже плавать на поверхности воды.
Один из наиболее характерных физических свойств щелочных металлов - их металлический блеск. Щелочные металлы имеют яркий металлический оттенок, что делает их легко отличимыми от других элементов. Они также хорошо проводят тепло и электричество, что делает их полезными в различных промышленных и технических приложениях.
Кроме того, щелочные металлы хорошо растворяются в воде и образуют сильно щелочные растворы. Их гидроксиды являются сильными основаниями и могут вызывать ожоги. Когда щелочные металлы реагируют с водой, они выделяются водород и образуют щелочные гидроксиды. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода.
Благодаря своим свойствам щелочные металлы имеют широкое применение в различных областях. Они используются в производстве щелочных батарей, телевизионных экранов, стекол, голубых пламенных светильников и других технических устройствах. Кроме того, некоторые щелочные металлы, такие как калий и литий, широко используются в фармацевтической и медицинской промышленности.
Третий представитель семейства щелочных металлов

Третьим представителем семейства щелочных металлов является калий. Этот элемент химического периодического стола обладает атомным номером 19 и обозначается символом K. Калий является мягким металлом серебристо-белого цвета, который легко реагирует с водой, образуя щелочную среду.
Химические свойства калия определяют его активность и способность образовывать соединения с другими элементами. Калий широко применяется в различных отраслях промышленности, а также в науке и медицине. Так, калий содержится во многих пищевых продуктах и является необходимым элементом для нормального функционирования организма человека.
Калий является важным элементом для растений, так как он играет ключевую роль в регуляции осмотического давления и участвует в обмене веществ. В природе калий можно найти в виде минералов, таких как сильвинит, карналлит и полевой шпат. В редких случаях калий может образовывать драгоценные кристаллы, такие как сильвин и лепидолит.
Химические свойства

Семейство щелочных металлов включает в себя такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть ряд общих химических свойств, которые делают их важными в различных областях науки и промышленности.
Одной из особенностей щелочных металлов является их высокая реактивность. Они легко взаимодействуют с кислородом воздуха, образуя оксиды или пероксиды. Также они реагируют с водой, образуя гидроксиды и выделяя водород. Эта химическая реакция и объясняет их способность быть взрывоопасными, когда они взаимодействуют с водой.
Кроме реактивности, щелочные металлы также обладают высоким теплопроводностью и электропроводностью. Они способны проводить электрический ток и тепло благодаря своей кристаллической структуре и наличию свободных электронов в их внешних электронных оболочках.
Важным химическим свойством щелочных металлов является их способность образовывать соли. Они реагируют с различными кислотами, образуя соли, которые находят широкое применение в пищевой промышленности, медицине, сельском хозяйстве и других сферах.
Также следует отметить, что щелочные металлы имеют низкую плотность и низкую температуру плавления, что делает их легкими и удобными для использования в различных технологиях.
Четвертый и последний элемент группы щелочных металлов

Четвертый и последний элемент группы щелочных металлов - это франций (Fr). Он является самым редким и реактивным элементом из всех щелочных металлов. Франций был открыт в 1939 году французскими учеными Андре Дебаин и Луисом Паулимом. Его название происходит от Франции, страны, в которой производилась его открытие.
Франций является мягким и серебристым металлом. Его атомный номер равен 87, а его атомная масса составляет около 223 г/моль. Из-за своей высокой реактивности, франций не встречается в природе в свободной форме. Вместо этого, он образуется как побочный продукт при распаде радия и актиния.
Франций обладает несколькими интересными химическими свойствами. Он является самым реактивным щелочным металлом и сильным окислителем. Он легко реагирует с водой, кислородом и другими неорганическими соединениями. Эти свойства делают его опасным и трудным в использовании.
Из-за своей реактивности и редкости, франций имеет ограниченное число применений. Он используется в научных исследованиях и ядерной энергетике, где его изотопы могут быть использованы в нейтронных и атомных реакторах. Кроме того, отдельные исследования показали потенциал франция в области медицины и радиохимии.
Распространение в природе
Щелочные металлы являются одними из самых распространенных элементов в земной коре. Они встречаются в различных минералах и геологических образованиях. Например, главный источник калия - патернит, находится в депозитах калийных солей. Натрий, в свою очередь, находится в виде минерала - халцедонита, который часто встречается в морской соли и воде. Распределение лития более равномерно, его можно найти в главном минерале - лепидолите, а также в рудах галюциногенного шпата и таунсенда.
Щелочные металлы также часто встречаются в природных резервуарах, таких как океаны и моря. Натрий находится в океанах в виде растворенной соли, которая образуется в результате эрозии земной коры. Калий, хотя и распространен в земной коре, все же в океанах его содержание намного ниже. Литий также находится в морской воде в малых концентрациях, однако его добыча из океанов до сих пор не является эффективным процессом.
Большое количество щелочных металлов также связано с процессом горения растительности и углеродных ископаемых, что приводит к их высвобождению в атмосферу. Эти элементы впоследствии растворяются и могут осаждаться в форме осадка на земле и в водоемах.
Вопрос-ответ

Какие вещества относятся к семейству щелочных металлов?
К семейству щелочных металлов относятся литий, натрий, калий, рубидий, цезий и франций.
Какие свойства характерны для щелочных металлов?
У щелочных металлов есть ряд характерных свойств: они мягкие, легковоспламеняемые и образуют оксиды и гидроксиды; ионизационные потенциалы щелочных металлов очень низкие, поэтому они легко отдают свои электроны; щелочные металлы образуют ионы M+, обладающие единичным зарядом.
Какие химические элементы входят в состав щелочных металлов?
Семейство щелочных металлов включает в себя следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каково природное вхождение щелочных металлов?
Щелочные металлы обычно не встречаются в природном виде, но их окиси, гидроксиды и соли широко распространены. Они встречаются в минералах, таких как галит (NaCl), целестин (SrSO4), сподумен (LiAlSi2O6) и других.
Какие особенности у каждого отдельного щелочного металла?
У каждого отдельного щелочного металла есть свои особенности. Например, литий обладает наименьшей плотностью и наименьшим ионизационным потенциалом. Калий является одним из наиболее распространенных элементов в земной коре. Цезий и франций являются самыми редкими щелочными металлами. Каждый из них имеет свои химические, физические и природные особенности.
