Щелочные металлы - это химический класс элементов, включающий в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются частью первой группы периодической системы элементов и отличаются высокой активностью и реактивностью.
Основными свойствами щелочных металлов являются низкая плотность, низкая температура плавления и высокая электропроводность. Они также обладают металлическим блеском и хорошо растворяются в воде, что делает их отличными проводниками электричества и тепла.
Еще одним важным свойством щелочных металлов является их реактивность с кислородом и водой. Они быстро реагируют с кислородом воздуха, образуя окислы, и образуют гидроксиды при воздействии на влажную атмосферу или воду. Благодаря этим свойствам, ѩелочные металлы имеют широкое применение в различных отраслях, включая производство батарей, сплавов, лазеров и фармацевтических препаратов.
В заключение, щелочные металлы обладают уникальными свойствами, которые делают их неотъемлемой частью многих промышленных и научных процессов. Их активность, реактивность и химические свойства позволяют использовать их в различных областях, от энергетики до медицины.
Свойства и применение щелочных металлов

Щелочные металлы – это группа химических элементов, которые находятся в первой группе периодической системы. К ним относятся литий, натрий, калий, рубидий, цезий и франций. У этих металлов много общих свойств, которые делают их особенно ценными и широко используемыми в различных областях науки и промышленности.
Одним из ключевых свойств щелочных металлов является их высокая реактивность. В контакте с кислородом они быстро окисляются, образуя оксиды. Также, они очень растворимы в воде и образуют щелочные растворы. Их реактивность делает их ценными в качестве реагентов и катализаторов в химической промышленности.
Щелочные металлы обладают малой плотностью, что делает их легкими и прочными конструкционными материалами. Они также обладают хорошей электропроводностью и высокой теплопроводностью. Благодаря этим свойствам, они широко используются в производстве батарей, литий-ионных аккумуляторов, а также в электронике и ведении крупных электрических токов.
Важным свойством щелочных металлов является их способность образовывать сплавы с другими металлами. Например, сплавы натрия и калия с алюминием обладают высокой прочностью и низкой плотностью, что делает их идеальными материалами для аэрокосмической промышленности и производства легких конструкций.
Щелочные металлы также имеют важное применение в медицине. Натрий и калий играют важную роль в поддержании нормального баланса электролитов в организме человека. Они используются в составе различных препаратов и растворов для инфузий при лечении различных заболеваний.
Что такое щелочные металлы?
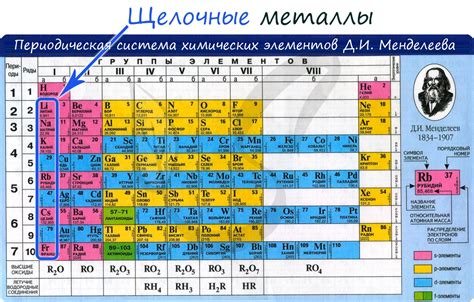
Щелочные металлы – это группа элементов периодической системы, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе элементов и характеризуются высокой активностью и реактивностью.
Химические свойства щелочных металлов обусловлены наличием одной валентной электронной оболочки с одним электроном. Это делает их очень реактивными, особенно в реакциях с водой и кислородом. Щелочные металлы легко реагируют с водой, образуя основания и выделяя водород. Они также образуют оксиды при реакции с кислородом.
Важной особенностью щелочных металлов является их низкая плотность, что делает их легкими элементами. Кроме того, они обладают низкой температурой плавления и кипения, а также хорошей электропроводностью. В связи с этим, щелочные металлы широко используются в различных областях, включая производство батарей, легких сплавов, пищевой промышленности и медицине.
Физические свойства щелочных металлов

Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть ряд характеристических физических свойств, которые делают их уникальными и широко используемыми в различных областях.
Первое заметное физическое свойство щелочных металлов - это их мягкость. В основном они имеют низкую твердость и могут быть разрезаны ножом. Например, литий - самый мягкий из щелочных металлов и даже может быть нарезан ножницами.
Второе важное физическое свойство - это низкая плотность щелочных металлов. Они имеют очень низкую плотность, что делает их легкими и удобными для использования в различных приложениях. Например, литий имеет плотность всего 0,53 г/см³, что является одной из самых низких плотностей среди всех металлов.
Третье важное физическое свойство - это низкие температуры плавления и кипения щелочных металлов. Они обладают очень низкими точками плавления и кипения, что делает их жидкими при относительно низких температурах. Например, натрий имеет точку плавления при 97,8 °C, а рубидий - при 39,3 °C.
Четвёртое физическое свойство, которое необходимо отметить, это высокая активность щелочных металлов. Они являются одними из самых активных металлов, что проявляется в их способности быстро реагировать с водой и другими веществами. Например, калий взрывается при контакте с водой, а франций настолько реактивен, что его трудно хранить и изучать.
Химические свойства щелочных металлов

Щелочные металлы – это ряд элементов, включающий литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они называются щелочными из-за образующихся при их реакциях гидроксидов, кислотные свойства которых проявляются в щелочной среде. Одной из основных особенностей щелочных металлов является их низкая электроотрицательность, что делает их очень реакционноспособными. Они способны образовывать ионы с положительным зарядом, образуя соль, и проводники электрического тока.
Щелочные металлы легко реагируют с кислородом, их поверхность быстро окисляется при контакте с воздухом. Особенно яркую реакцию окисления наблюдают с калием и цезием. Окисление сопровождается выделением интенсивного пламени и образованием оксидов металлов.
Щелочные металлы реагируют с водой, образуя гидроксиды и высвобождая водород. Реакция с водой происходит очень быстро, особенно с калием и натрием. Образующийся гидроксид щелочного металла является сильным основанием и растворяется в воде, образуя щелочные растворы.
В химических реакциях щелочные металлы имеют склонность отдавать электроны, образуя положительные ионы. Их ионы легко взаимодействуют с отрицательно заряженными ионами, образуя соли. Из-за высокой реакционной способности щелочные металлы не встречаются в свободном состоянии природы, а образуют различные соединения, включая минералы.
Применение щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и другие, имеют широкий спектр применения в различных областях.
1. Производство щелочных элементов: Литий и калий используются в производстве современных аккумуляторов и батарей. Это происходит благодаря высокой энергетической плотности и долгому сроку службы этих элементов.
2. Химическая промышленность: Натрий и калий используются в производстве различных химических веществ, таких как щелочи, соли и карбиды. Они являются важными компонентами при производстве мыла, стекла, удобрений и других продуктов.
3. Медицина: Литий широко применяется в медицине для лечения психических расстройств, таких как биполярное расстройство и депрессия. Калий также используется в медицине для поддержания нормального функционирования сердца и нервной системы.
4. Энергетика: Литий-ионные аккумуляторы являются ключевыми компонентами мобильных устройств, электромобилей и солнечных батарей. Они обеспечивают эффективное хранение энергии и обладают высокой устойчивостью к разряду.
5. Металлургия: Калий используется в процессе производства алюминия, железа и др. металлов. Он используется для удаления кислорода из алюминиевого расплава и повышения пластичности стали.
6. Пиротехника: Некоторые щелочные металлы, такие как литий, натрий и калий, широко используются в пиротехнике для создания различных видов огня и световых эффектов.
В целом, щелочные металлы играют важную роль в различных сферах нашей жизни - от энергетики и химии до медицины и пиротехники. Их уникальные свойства и применимость делают их неотъемлемым ингредиентом многих современных технологий и продуктов.
Влияние щелочных металлов на окружающую среду

Щелочные металлы, такие как литий, натрий, калий и др., имеют заметное влияние на окружающую среду, особенно при их использовании в различных сферах жизнедеятельности человека.
Одним из главных проблем влияния щелочных металлов является их относительная реактивность и летучесть. Использование щелочных металлов может приводить к возникновению опасных химических реакций, в результате которых могут выделяться токсичные и вредные вещества. Например, при сжигании лития или его соединений может образовываться такой газ, как оксид лития, который является весьма опасным для окружающей среды и здоровья.
Кроме того, щелочные металлы могут оказывать негативное влияние на почву и воду в результате их применения в сельском хозяйстве и промышленности. Калийные удобрения, которые широко используются в сельском хозяйстве, могут вызывать перегноение почвы и загрязнение подземных вод пестицидами, аммиаком и другими веществами, что приводит к нарушению экосистемы и угрожает биоразнообразию.
Важно отметить, что влияние щелочных металлов на окружающую среду не всегда отрицательное. Например, литий широко используется в производстве аккумуляторов для электромобилей, что способствует снижению выбросов вредных веществ в атмосферу и сокращению загрязнения окружающей среды. Кроме того, щелочные металлы могут применяться в процессах очистки воды и воздуха, что способствует улучшению качества жизни и сохранению природных ресурсов.
Таким образом, влияние щелочных металлов на окружающую среду является двусторонним: с одной стороны, они могут вызывать негативные последствия для экологии и здоровья человека, с другой стороны, правильное использование их свойств может способствовать сохранению окружающей среды и снижению негативного воздействия на нее.
Вопрос-ответ

Зачем нужны щелочные металлы?
Щелочные металлы имеют широкое применение в различных областях. Например, натрий и калий используются в пищевой промышленности в качестве добавок в пищевые продукты. Литий и его соединения используют в производстве аккумуляторов и оборудования с высокими энергетическими требованиями. Рубидий и цезий находят применение в оптической электронике, лазерных технологиях, ядерной энергетике и научных исследованиях. Калийшишечный удобрение, ca(oh)2 применяется для уничтожение негативных веществ в почве и для повышение уровня воды.
Каковы основные свойства щелочных металлов?
Щелочные металлы обладают некоторыми общими свойствами. Они очень реактивны и легко реагируют с водой, выделяя водород. Они имеют низкую плотность и низкую температуру плавления и кипения. Щелочные металлы также хорошо проводят тепло и электричество. Они образуют ионы с положительным зарядом и легко образуют соединения с другими элементами.
Какие опасности связаны с использованием щелочных металлов?
Использование щелочных металлов может быть опасным из-за их высокой реактивности. Например, натрий и калий реагируют с водой, образуя взрывоопасный газ водород. Рубидий и цезий являются радиоактивными и могут вызывать серьезные проблемы со здоровьем при неправильной эксплуатации. Кроме того, многие соединения щелочных металлов могут быть токсичными и вызывать раздражение кожи и слизистых.
Какие материалы могут использоваться для обработки щелочных металлов?
Щелочные металлы очень реактивны и требуют особой осторожности при обработке. Для обработки щелочных металлов могут использоваться материалы, которые не реагируют с ними. Например, нержавеющая сталь или стекло могут быть использованы для хранения и переноски щелочных металлов. Также можно применять специальные рукава или оборудование из полимерных материалов, которые не реагируют с щелочными металлами.
