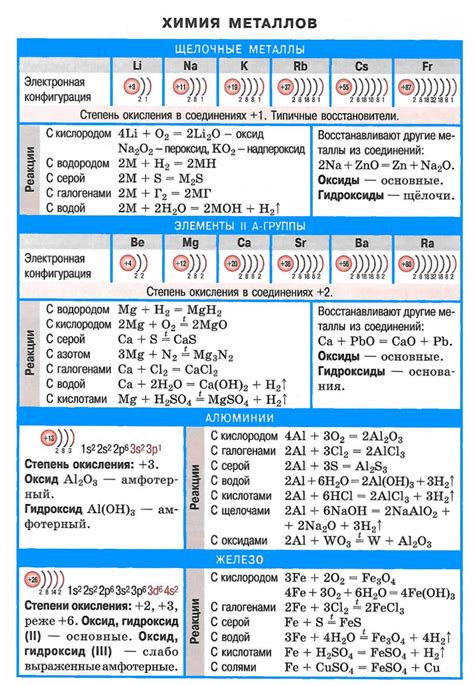
Семейство щелочноземельных металлов состоит из шести элементов: бериллия, магния, кальция, стронция, бария и радия. Эти элементы являются важными в природе и находят широкое применение в различных областях человеческой деятельности.
Одной из основных особенностей щелочноземельных металлов является их активность. Они хорошо реагируют с кислотами, образуя соли и выводя водород. Кроме того, они обладают высокой электропроводностью и хорошо проводят тепло. Эти свойства делают их неотъемлемыми компонентами множества промышленных процессов и технологий.
Каждый элемент из семейства щелочноземельных металлов обладает своими уникальными свойствами. Например, бериллий обладает высокой твердостью, прочностью и низким коэффициентом теплового расширения, что делает его необходимым материалом для изготовления прецизионных приборов и оптических систем. Магний является легким и прочным металлом, который широко используется в авиационной и автомобильной промышленности. Кальций играет важную роль в организме человека, обеспечивая крепость костей и зубов.
Семейство щелочноземельных металлов отличается своей универсальностью и важностью в различных сферах жизнедеятельности человека. Изучение и применение этих элементов играют важную роль в развитии науки и технологий.
Семейство щелочноземельных металлов

Щелочноземельные металлы - это элементы, относящиеся к группе 2 периодической таблицы химических элементов. Это бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Основная характеристика щелочноземельных металлов - их высокая химическая активность. Они имеют два электрона на внешнем энергетическом уровне, что делает их надежными донорами электронов. Эти металлы образуют ионные соединения с отрицательно заряженными ионами, такими как галогены. При взаимодействии с кислородом они образуют оксиды.
Одной из особенностей щелочноземельных металлов является их низкая плотность и недолговечность.
Щелочноземельные металлы также представляют интерес в связи с их использованием в различных отраслях промышленности и технологий. Например, магний используется в производстве легких сплавов, кальций используется в процессе производства стали и для увеличения выносливости бетона, барий используется в медицине в качестве контрастного вещества при рентгенологическом исследовании, а радий применяется в терапии опухолей.
Все щелочноземельные металлы являются химически активными, но их активность возрастает с увеличением атомного номера. Также, они обладают сходными свойствами на физическом уровне: высокой термической и электрической проводимостью, низкой температурой плавления и кипения, мягкостью и дружелюбной химической реакцией с водой.
- Бериллий (Be) - легкий и прочный металл, обладает высокой проводимостью тепла и электричества;
- Магний (Mg) - легкий металл, является важным компонентом сплавов, использование в медицине и в производстве батарей;
- Кальций (Ca) - важный минерал для организма, необходим для поддержания костной системы и нормализации работы нервной системы;
- Стронций (Sr) - используется в производстве пиротехнических смесей, фармацевтической и электронной промышленности;
- Барий (Ba) - широко используется в медицине и радиологии, также применяется в нефтедобывающей отрасли и в производстве стекла;
- Радий (Ra) - радиоактивный металл, используется для научных исследований и в нефтяной промышленности.
Основные свойства щелочноземельных металлов

Щелочноземельные металлы - это группа элементов периодической таблицы, включающая бериллий, магний, кальций, стронций, барий и радий. Они являются химически активными металлами и обладают рядом характерных свойств.
- Первое свойство щелочноземельных металлов - высокая реакционность. Они легко реагируют с водой, кислородом и другими реагентами, образуя соединения.
- Щелочноземельные металлы обладают низкой плотностью, что делает их легкими и мягкими материалами. Например, магний имеет плотность всего 1,74 г/см³.
- Щелочноземельные металлы хорошо проводят тепло и электричество. Бериллий и магний широко используются в электронике благодаря своим электропроводным свойствам.
- Эти металлы обладают высокой температурной устойчивостью. Они обычно образуют стабильные соединения даже при высоких температурах.
- У щелочноземельных металлов хорошая способность к образованию ионов с положительным зарядом. В результате этого они образуют идеально кристаллическую структуру в кристаллах и октаэдрах.
Из-за своих уникальных свойств щелочноземельные металлы находят широкое применение в различных областях, включая производство сплавов, электронику и строительство.
Химические реакции и свойства
Щелочноземельные металлы являются очень реактивными элементами, и их химические свойства основаны на их низкой электроотрицательности и высокой электроноактивности. Они образуют соединения с большинством элементов и органических соединений.
Одно из ключевых свойств щелочноземельных металлов - их реакция с водой. Когда они попадают в контакт с водой, происходит сильное выделение водорода и образуется гидроксид металла. Например, реакция кальция с водой приводит к появлению пузырьков водорода. Это явление основано на активности щелочноземельных металлов в реакциях с водой.
Щелочноземельные металлы также образуют ионы, имеющие положительный заряд, легко взаимодействующие с отрицательно заряженными ионами. Например, магний может образовывать хлоридный и сульфатный ионы.
Еще одним интересным свойством щелочноземельных металлов является их способность образовывать сплавы с другими металлами, улучшая их структуру и свойства. Например, магний используется в сплавах с алюминием для увеличения прочности и легкости материала.
Щелочноземельные металлы также имеют высокую температуру плавления и практически не растворимы в воде. Они обладают металлическим блеском и хорошими электропроводными свойствами. Некоторые из них, такие как магний и кальций, часто используются в промышленности и находят применение в различных отраслях, включая авиацию, автомобильное производство и строительство.
Реакция щелочноземельных металлов с водой

Щелочноземельные металлы - это группа химических элементов в периодической таблице, которая включает в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Одной из важных особенностей этих металлов является их реакция с водой.
В отличие от щелочных металлов, которые активно реагируют с водой, щелочноземельные металлы реагируют более медленно. Однако, они все равно обладают способностью образовывать гидроксиды и выделять водородный газ.
Самый активный щелочноземельный металл - бериллий. Он реагирует очень медленно с водой и образует гидроксид бериллия (Be(OH)2). Магний также медленно реагирует с водой, образуя гидроксид магния (Mg(OH)2) и выделяя водородный газ.
Чем больше атомный номер у щелочноземельного металла, тем быстрее он реагирует с водой. Кальций, стронций, барий и радий реагируют быстрее и образуют соответствующие гидроксиды: Ca(OH)2, Sr(OH)2, Ba(OH)2 и Ra(OH)2.
Реакция щелочноземельных металлов с водой является экзотермической, то есть выделяется тепло. Каждый из этих металлов имеет разную скорость реакции с водой и разную степень активности. Они также обладают высокой ионизационной энергией и обладают свойством образовывать двухатомные катионы в растворах.
Электронные конфигурации каждого из этих металлов имеет два электрона в s-подуровне, что делает их устойчивыми к реакции с водой. Однако, при реакции щелочноземельных металлов с кислородом они становятся менее устойчивыми.
Физические свойства щелочноземельных металлов

Щелочноземельные металлы - это химический ряд элементов, включающий бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У этих металлов есть ряд физических особенностей, которые отличают их от других элементов.
Плотность и твердость: Щелочноземельные металлы обладают относительно высокой плотностью и твердостью. Например, плотность бериллия составляет 1,85 г/см³, а плотность радия достигает 5 г/см³. Твердость этих металлов также выше, чем у других элементов даже при комнатной температуре.
Температурный диапазон плавления и кипения: Щелочноземельные металлы имеют относительно высокие температуры плавления и кипения. Например, кальций плавится при температуре 839 градусов Цельсия, а его кипение происходит при температуре около 1484 градусов Цельсия. Эти значения выше, чем у многих других металлов.
Электропроводность: Щелочноземельные металлы обладают высокой электропроводностью. Это связано с наличием свободных электронов в их структуре. Электрический ток легко проходит через эти металлы, что делает их полезными в различных электрических приборах и схемах.
Пластичность и формование сплавов: Щелочноземельные металлы обладают хорошей пластичностью и способностью к формованию. Это позволяет использовать их в производстве различных изделий, начиная от проводов и кабелей, до авиационных деталей и скульптурных изделий. Более того, эти металлы могут образовывать сплавы с другими элементами, расширяя их применение и свойства.
Реакция со средой: Щелочноземельные металлы реагируют с воздухом и водой. Они быстро окисляются на воздухе, покрываясь тонкой оксидной пленкой. В контакте с водой они образуют щелочь, особенно реактивные из них, такие как кальций и барий. Эта реакция может привести к искривлению и растворению металла.
В целом, физические свойства щелочноземельных металлов делают их полезными и важными во многих отраслях промышленности и науки.
Применение щелочноземельных металлов
Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, имеют широкий спектр применений в различных областях науки и технологий.
Бериллий обладает высокой прочностью и легкостью, поэтому его широко используют в производстве легких и прочных сплавов для авиации и космической промышленности. Бериллий также обладает хорошими свойствами проводимости тепла и является незаменимым материалом для создания ядерных реакторов и лазеров.
Магний имеет низкую плотность и хорошую прочность, что делает его идеальным материалом для изготовления легких и прочных сплавов. Магнийные сплавы нашли свое применение в авиационной, автомобильной и судостроительной промышленности, а также в производстве спортивных инструментов и оружия.
Кальций широко используется в металлургической промышленности для обработки стали и других металлов. Кальций также играет важную роль в производстве строительных материалов, сельском хозяйстве и медицине.
Стронций используется в производстве пиротехнических изделий, таких как фейерверки и сигнальные ракеты, благодаря своим ярким красным и зеленым световым эффектам. Стронций также применяется в радиоактивном лечении рака костей.
Барий используется в производстве рентгеновских и гамма-излучающих трубок для медицинских и промышленных целей. Бариевые соединения широко применяются в сельском хозяйстве для улучшения плодородия почвы и в производстве жидкости для контрастного усиления при рентгенологических исследованиях.
Радий используется в научных исследованиях и в медицине, особенно в радиотерапии для лечения раковых заболеваний. Радий также применяется для производства светящихся красок и покрытий, а также в производстве ядерного топлива.
Применение в промышленности

Щелочноземельные металлы находят широкое применение в различных отраслях промышленности благодаря своим уникальным свойствам. Например, бериллий используется в производстве высокоточных электронных приборов и лазеров, так как он обладает высокой прочностью, теплопроводностью и стабильностью. Это делает его идеальным материалом для создания компонентов, которые должны выдерживать экстремальные условия работы.
Магний широко применяется в автомобильной и авиационной промышленности из-за своей низкой плотности и хороших механических свойств. Его сплавы используются для создания легких и прочных деталей, таких как кузова автомобилей, винты самолетов и облицовки космических аппаратов. Кроме того, магний используется в производстве огнеупорных материалов, медицинских имплантатов и сплавов для хирургического инструментария.
Кальций находит применение в производстве стали и сплавов, в процессе дессикации (высушивания) огнетушителей и строительных материалов, в химической промышленности для получения цианированных солей, газообразного хлорида кальция и других химических соединений. Он также используется в производстве керамики и стекла.
Применение в научных исследованиях

Семейство щелочноземельных металлов, состоящее из бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra), имеет широкий спектр применений в научных исследованиях.
Бериллий наиболее известен своими уникальными физическими свойствами: он обладает высокой термостойкостью, прозрачностью для рентгеновского излучения и низкой плотностью. Это позволяет использовать его в качестве надежной защиты от радиации и строительного материала для медицинских и научных приборов.
Магний и его сплавы широко применяются в аэрокосмической и автомобильной промышленности благодаря своей легкости и прочности. Он также является важным элементом для производства батарей и взрывчатых веществ.
Кальций играет важную роль в биологических процессах организма и используется во многих биохимических исследованиях. Он является неотъемлемым компонентом костей и зубов, а также участвует в свертывании крови и функционировании нервной системы.
Стронций и барий используются в радиовещании и осветительных устройствах. Они обладают способностью излучать интенсивное световое излучение при возбуждении и широко применяются в фосфорных материалах для показа картины на телевизионных экранах и в аппаратах рентгеновской и гамма-терапии.
Радий, являющийся самым тяжелым и радиоактивным элементом в этом семействе, использовался в прошлом в лечении рака, но из-за его опасных свойств, его применение было значительно ограничено.
Вопрос-ответ

Какие элементы входят в состав семейства щелочноземельных металлов?
Семейство щелочноземельных металлов включает следующие элементы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Каковы основные свойства щелочноземельных металлов?
Основные свойства щелочноземельных металлов следующие: они являются мягкими, низко плавкими, хорошо ведущими тепло и электричество, обладают высокой реактивностью, способностью образовывать оксиды и гидроксиды.
Какие значения имеет электроотрицательность у щелочноземельных металлов?
Электроотрицательность щелочноземельных металлов увеличивается по мере движения в периодической системе: от бериллия (1.57) до радия (0.89).
В чем особенность реакции щелочноземельных металлов с водой?
Реакция щелочноземельных металлов с водой протекает с образованием гидроксидов и выделением водорода. Однако, по сравнению с щелочными металлами, реакция щелочноземельных металлов с водой менее интенсивная и медленная.
