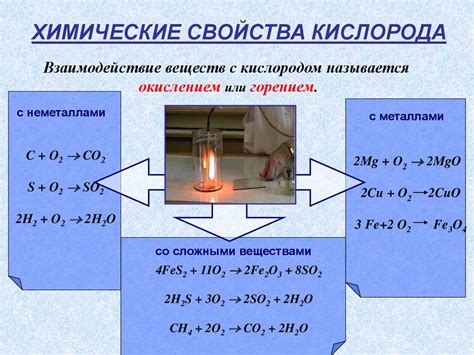
Металлы – это вещества, которые обладают высокой электропроводностью и металлическим блеском. Они играют важную роль в нашей жизни и находят применение во многих отраслях, начиная от строительства и заканчивая производством электроники. Однако не все металлы одинаково активны. Некоторые из них активно реагируют с окружающей средой, в то время как другие остаются стабильными и инертными.
Активность металлов определяется их способностью образовывать химические соединения путем совершения электронных переходов. Один из способов оценивать активность металлов – это их способность электрохимически реагировать с различными веществами. Важной характеристикой активных металлов является их склонность к окислению – они легко отдают электроны в окружающую среду.
Самым активным металлом по этому параметру является щелочной металл – цезий. Он гораздо активнее своих соседей в периодической системе – лития, натрия, калия и рубидия. Цезий является мягким металлом серебристого цвета, его плоть на ощупь напоминает пробку. Цезий также обладает высоким температурным расширением и может выходить на поверхность при росте кристаллов. Он используется в научных исследованиях, а также в производстве фотоэлементов, лазерных систем и ядерных реакторов.
Самый активный металл: какой на первом месте?

Активность металла определяется его способностью взаимодействовать с другими веществами, особенно воздухом и водой. Самым активным металлом считается фреониум, который занимает первое место на этом списке.
Фреониум – это металл сильно реактивный и легко окисляется при контакте с воздухом. Поэтому он хранится под водой или в аргоновой среде. Фреониум еще нельзя получить в крупных количествах, поскольку он очень опасен и может вызвать серьезные химические аварии.
Одной из достопримечательностей фреония является его способность реагировать с водой, что приводит к образованию водорода и усилению пламени. Также этот металл реагирует с кислородом, аммиаком и другими химическими соединениями.
Таким образом, выбор самого активного металла неоднозначен и зависит от контекста. Однако, среди металлов, фреониум занимает первое место благодаря его высокой реактивности и быстрой окисляемости.
Факторы определения активности металлов

Активность металлов – это их способность взаимодействовать с другими веществами. Существует несколько факторов, которые определяют, насколько активным является тот или иной металл.
Первый фактор – электроотрицательность. Чем выше электроотрицательность металла, тем менее он активен. Это связано с тем, что металлы с высокой электроотрицательностью обладают большими тенденциями к принятию электронов и образованию положительных ионов.
Второй фактор – реакционная способность. Металлы, которые легко реагируют с другими веществами, считаются более активными. Например, натрий и калий имеют высокую реакционную способность и активно взаимодействуют с водой.
Третий фактор – потенциал окисления. Чем более положительный потенциал окисления у металла, тем он активнее. Металлы с высокими значениями потенциала окисления, такие как калий или натрий, способны образовывать стабильные ионы.
Кроме того, активность металла может зависеть от его группы в периодической системе. Металлы 1 и 2 групп обычно более активные, так как они имеют меньшую электроотрицательность и более низкий потенциал окисления.
Стоит отметить, что активность металлов может проявляться не только в химических реакциях, но и в их физических свойствах, таких как электропроводность или пластичность.
Первые стройные металлы

Самый активный металл - это фтор. Он относится к группе галогенов и является самым электроотрицательным элементом в периодической системе химических элементов. Фтор имеет большую реакционную способность и может образовывать стойкие соединения с другими элементами.
Далее в списке активных металлов следует кислород. Он является вторым по электроотрицательности элементом и активно вступает в химические реакции. Кислород образует многочисленные оксиды и кислородсодержащие соединения.
На третьем месте находится хлор. Этот элемент также принадлежит к группе галогенов и обладает высокой электроотрицательностью. Хлор формирует стойкие соединения с другими элементами и широко используется в производстве промышленных и бытовых химикатов.
Все эти металлы имеют большую реакционную способность и широко используются в различных отраслях промышленности и научных исследованиях. Их активность связана с тем, что они стремятся получить полный внешний электронный слой и при этом готовы отдать или принять электроны от других элементов.
Металлы группы 1

Металлы группы 1 – это химическая группа элементов периодической системы, также известная как щелочные металлы. К ним относятся такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми активными металлами в периодической системе.
Щелочные металлы обладают рядом общих химических свойств. Они являются мягкими, легко режутся ножом, имеют низкую плотность и низкую температуру плавления. Кроме того, они высоко реактивны и легко реагируют с водой, аммиачными соединениями и кислородом.
Литий, первый элемент группы 1, является наименее реактивным. Он обладает наименьшей электроотрицательностью и наименьшей плотностью среди щелочных металлов. Литий широко используется в батарейках и аккумуляторах благодаря своим химическим свойствам.
Натрий и калий также являются важными металлами группы 1. Они широко применяются в пищевой промышленности, фармацевтике и других отраслях. Натрий используется для соления и консервирования продуктов, а калий – для поддержания нормального уровня электролитов в организме.
Рубидий, цезий и франций являются редкими и наиболее реактивными элементами группы 1. Их применение ограничено из-за их высокой реактивности и токсичности. Однако, они находят применение в научных исследованиях и некоторых специализированных областях, таких как производство атомных часов.
Металлы группы 2

Металлы группы 2 - это химические элементы, расположенные во второй группе периодической таблицы. Они часто называются щелочноземельными металлами и включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Щелочноземельные металлы обладают несколькими общими свойствами. Во-первых, они имеют две валентности: +2 и +1. Во-вторых, они реагируют с водой, образуя щелочи и выделяя водород. Это происходит из-за их высокой реакционной способности. Кроме того, эти металлы являются отличными проводниками электричества и тепла.
Бериллий, один из металлов группы 2, имеет много полезных свойств. Он обладает высокой прочностью и жаростойкостью, что делает его идеальным материалом для использования в промышленности и авиации. Магний также находит широкое применение в различных отраслях благодаря своей низкой плотности и хорошим механическим свойствам.
Кальций является необходимым элементом для здоровья человека и животных. Он участвует во многих биологических процессах, включая образование и поддержку костей и зубов. Стронций и барий также имеют множество применений в различных отраслях, включая металлургию и медицину.
Радий - самый тяжелый и радиоактивный из металлов группы 2. Из-за его высокой радиоактивности, радий представляет опасность для здоровья человека и требует осторожного обращения.
Металлы группы 2 играют важную роль в различных отраслях промышленности и науки. Их уникальные свойства делают их незаменимыми материалами в различных приложениях и исследованиях.
Лантаниды и актиниды

Лантаниды и актиниды представляют собой группы элементов, которые находятся в расширенной периодической системе химических элементов под общим названием «внутренние переходные металлы». Лантаниды включают элементы с атомными номерами от 57 до 71, а актиниды — с атомными номерами от 89 до 103.
Одной из основных особенностей лантанидов и актинидов является их высокая активность. Эти элементы обладают способностью к реакциям с водой, кислородом и другими химическими соединениями, что позволяет им проявлять свои уникальные свойства.
Лантаниды и актиниды широко используются в различных отраслях промышленности, включая производство ламп, магнитов, катализаторов и других важных материалов. Благодаря своей высокой активности, эти элементы являются ценным и неотъемлемым компонентом во многих технологических процессах и находят широкое применение в современных технологиях.
Переходные металлы

Переходные металлы - это группа химических элементов, которые находятся в таблице Менделеева между блоками s и p. Они имеют характерную структуру электронных оболочек и обладают особыми химическими свойствами.
Переходные металлы отличаются высокой пластичностью и проводимостью тепла и электричества. Они также обладают способностью образовывать соединения с различными степенями окисления, что делает их полезными для множества индустриальных и технологических процессов.
В таблице Менделеева переходные металлы расположены в середине блока d. Они включают элементы от скандия (Z=21) до цинка (Z=30) в первом периоде блока d и элементы от иттрия (Z=39) до риссия (Z=57) во втором периоде блока d. Другие переходные металлы принадлежат к группам d-блока и расположены в других периодах.
Переходные металлы широко используются в различных областях, включая металлургию, электротехнику, химическую промышленность и многие другие. Они играют важную роль в разработке новых материалов и технологий, а также в современной науке и исследованиях.
Металлы в последних группах
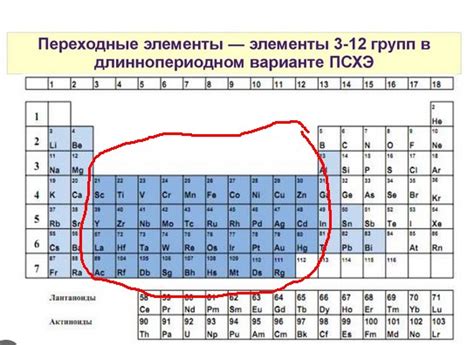
В таблице Менделеева металлы находятся справа от линии, разделяющей металлы и неметаллы. Металлы в последних группах таблицы Менделеева обладают особыми химическими свойствами и часто используются в различных отраслях промышленности.
Одним из наиболее известных металлов из последних групп является медь. Медь обладает высокой электропроводностью и теплопроводностью, что делает ее незаменимым материалом для проводов и различных электротехнических устройств. Кроме того, медь широко используется в производстве отопительных систем и водопроводных труб.
Еще одним важным металлом из последних групп является цинк. Цинк используется в качестве антикоррозийного покрытия для различных металлических изделий, таких как автомобили, металлическая тара и строительные конструкции. Кроме того, цинк является необходимым микроэлементом для организма человека и используется в фармацевтической и пищевой промышленности.
Еще одним интересным металлом из последних групп является мышьяк. Мышьяк является одним из самых ядовитых веществ и широко применяется в промышленности, например, в производстве полупроводников и стекла. Кроме того, мышьяк используется в медицине для лечения определенных заболеваний.
Каждый из металлов в последних группах таблицы Менделеева имеет свои особенности и применение в различных областях. Их свойства и возможности придают новые возможности для развития науки и промышленности.
Вопрос-ответ

Какой металл является самым активным?
Самым активным металлом является франций (Fr) - мягкий серебристо-белый элемент четвёртой группы периодической системы.
Почему франций считается самым активным металлом?
Франций считается самым активным металлом, потому что он имеет самую низкую ионизационную энергию и самую высокую электроотрицательность среди всех элементов. Это означает, что он легко отдает свой электрон и активно реагирует с другими веществами.