Взаимодействие металлов с водородом является основной реакцией, которая происходит при образовании металлических оксидов. Однако существуют исключения, металлы, оксиды которых не реагируют с водородом, что делает их уникальными и востребованными в различных отраслях промышленности и науки.
Первым металлом из списка является платина. Ее оксиды не реагируют с водородом даже при высоких температурах. Помимо своей устойчивости к водороду, платина обладает высокой коррозионной стойкостью, высокой плотностью и температурной устойчивостью. Все это делает платину неотъемлемой составляющей в различных промышленных процессах и в производстве катализаторов.
Также среди металлов, оксиды которых не реагируют с водородом, стоит выделить золото. Золото является одним из самых редких и ценных металлов на Земле. Оно обладает непревзойденной устойчивостью к воздействию водорода и кислорода, что делает его идеальным материалом для изготовления ювелирных изделий и использования в электронике и космической промышленности.
Таким образом, существует небольшой список металлов, оксиды которых не реагируют с водородом. Эти металлы обладают уникальными свойствами, которые делают их востребованными в различных отраслях промышленности. Их устойчивость к водороду позволяет использовать эти металлы в условиях, когда остальные металлы не способны выдержать воздействие водорода.
Металлы, устойчивые к реакции с водородом

Существует ряд металлов, оксиды которых не реагируют с водородом. Это связано с особыми свойствами данных металлов и их способностью образовывать оксидные пленки на поверхности, которые эффективно защищают их от взаимодействия с водородом.
Один из таких металлов - алюминий. Алюминий обладает большой защитной способностью оксидной пленки, которая образуется на его поверхности при контакте с кислородом. Эта пленка плотно прилегает к металлу и предотвращает взаимодействие алюминия с водородом.
Другим металлом, устойчивым к реакции с водородом, является магний. Магний обладает хорошей коррозионной устойчивостью благодаря образованию прочной оксидной пленки. Эта пленка предупреждает реакцию с водородом и позволяет магнию сохранять свои химические и физические свойства.
Еще одним металлом, имеющим высокую стойкость к реакции с водородом, является нержавеющая сталь. Она содержит хром, который образует пассивную оксидную пленку на поверхности металла. Эта пленка предотвращает взаимодействие стали с водородом и обеспечивает долговечность конструкций из нержавеющей стали.
Таким образом, некоторые металлы обладают устойчивостью к реакции с водородом благодаря образованию защитных оксидных пленок на их поверхности. Это делает их применение в различных областях промышленности и техники надежным и безопасным.
Медь

Медь – химический элемент с атомным номером 29 и символом Cu. Она относится к группе металлов, оксиды которых не реагируют с водородом. Медь является довольно редким металлом и обладает высокой электропроводностью и теплопроводностью.
Оксид меди (CuO) не реагирует с водородом при обычных условиях. Это означает, что медь нереактивна с водородом и не образует газообразные соединения, такие как водородное оксид меди (CuOH). Это свойство делает медь незаменимым материалом для производства электрических проводов, труб и различных видов металлических изделий.
Медь имеет множество практических применений благодаря своей химической устойчивости и электропроводности. Она используется в производстве электротехнических проводов, монет, украшений, а также в производстве различных металлических изделий, таких как кухонная посуда и сантехнические изделия. Кроме того, медь применяется в различных химических процессах и в производстве сплавов.
Серебро

Серебро - химический элемент с атомным номером 47 и символом Ag. Он является благородным металлом, который относится к платиновой группе элементов. Серебро имеет блестящий серебристо-белый цвет и отличается высокой теплопроводностью и электропроводностью.
Оксиды серебра, такие как Ag2O и AgO, не реагируют с водородом. Это связано с высокой химической инертностью серебра. В результате этого серебро обладает стабильностью и не подвержено окислению в присутствии водорода.
Серебро часто используется в ювелирном деле, изготовлении посуды и монет, а также в электронике и фотографии. Благодаря своим антибактериальным свойствам, серебро также находит применение в медицине и водоочистке. Невозможность реакции оксидов серебра с водородом делает его еще более ценным и надежным материалом во многих областях применения.
Золото

Золото - драгоценный металл с характерным блестящим желтоватым оттенком. Этот металл отличается высокой устойчивостью к окружающей среде, поэтому его оксиды не реагируют с водородом.
Золото является одним из самых старых известных металлов в истории человечества. Оно используется в ювелирном искусстве, промышленности электроники, медицины и других отраслях. Благодаря своей устойчивости и яркому цвету, золото стало символом богатства и роскоши.
Оксиды золота, такие как Au2O3 и AuOH, обладают высокой устойчивостью и не реагируют с водородом. Это делает золото очень полезным материалом для различных процессов, требующих электропроводности и химической стабильности.
Вместе с тем, золото может вступать в реакцию с другими элементами, исключая водород. Например, золото растворяется в растворах цианида, что позволяет его использование в процессе обработки руды. Кроме того, золото может образовывать сплавы с другими металлами, такие как серебро или медь, для придания им различных свойств и цветовых оттенков.
Платина

Платина - редкий благородный металл серебристо-белого цвета. В инертной среде платина стойка к коррозии и не проявляет активность к водороду. Образуется всего несколько соединений платины с кислородом, и оксиды платины не реагируют с водородом. Благодаря этому свойству платина широко используется в различных отраслях промышленности.
Платина имеет высокую плотность и температуру плавления, поэтому она применяется в ювелирной и часовой промышленности. Она также является незаменимым материалом в производстве электродов для химических процессов, в катализе и космической промышленности.
Одним из наиболее известных свойств платины является ее инертность к кислотам и щелочам. Она не реагирует с водой, солями и щелочами, что делает ее пригодной для использования в химической лаборатории. Платина также является хорошим проводником электричества и тепла, что находит применение в электротехнике и производстве электроники.
Помимо этого, платина применяется в производстве автомобилей, особенно в системах очистки выхлопных газов, благодаря своим катализаторным свойствам. Она способствует превращению вредных выбросов в более безопасные соединения. Платина также используется в медицине, в частности, для изготовления имплантатов и протезов.
Палладий

Палладий – драгоценный металл из группы платиновых металлов. Его атомный номер равен 46. Палладий является серебристо-белым металлом с блестящей поверхностью и относительно низкой плотностью. Он обладает высокой термической стойкостью и химической инертностью.
Оксид палладия (PdO) является основным оксидом палладия. Этот оксид образуется при нагревании палладия в кислороде. Однако, оксид палладия не реагирует с водородом при обычных условиях. Это свойство указывает на химическую инертность палладия и делает его устойчивым к воздействию водорода.
Палладий используется в различных областях, включая производство катализаторов, электроники, ювелирных изделий и медицинского оборудования. Благодаря своей химической инертности и термической стойкости, палладий находит применение в катализаторах для различных химических процессов, включая производство полимеров, производство лекарственных препаратов и очистку выхлопных газов.
Кроме того, палладий используется в электронике для производства контактных площадок на полупроводниковых приборах и для создания специальных сплавов, используемых в изготовлении современных технологичных изделий, таких как смартфоны и ноутбуки.
Таким образом, палладий – металл, оксиды которого не реагируют с водородом. Это свойство позволяет использовать палладий в различных промышленных отраслях, где требуется высокая химическая инертность и термическая стойкость.
Железо

Железо – одна из самых распространенных и важных химических элементов. Оно является одним из основных компонентов земной коры и имеет широкое применение в различных отраслях промышленности. В условиях нормальных температур и давлений железо не реагирует с водородом, что делает его особым и важным металлом.
Железо находится на 4-м месте в списке самых распространенных элементов в земной коре. Оно обладает хорошей химической устойчивостью и не подвергается быстрой коррозии при контакте с водой или водородом. Это делает железо незаменимым материалом для строительства мостов, зданий, автомобильных деталей и других конструкций, которые должны быть прочными и долговечными.
Качественное железо имеет гладкую поверхность, не имеющую вмятин и повреждений. Однако, при взаимодействии с водородом, железо может образовывать оксиды, которые снижают его механическую прочность. Поэтому железо должно быть защищено от воздействия влаги или подвергаться специальной обработке, чтобы сохранить свои качественные характеристики.
Алюминий: металл, оксиды которого не реагируют с водородом
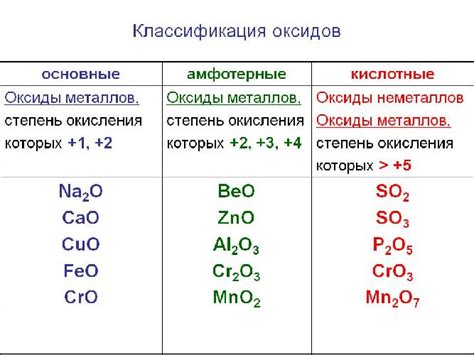
Алюминий - легкий, прочный и хорошо проводящий тепло и электричество металл. Он обладает защитной оксидной пленкой на поверхности, которая предотвращает его взаимодействие с водородом.
Оксиды алюминия, такие как алюминиевая фольга или алюминиевая пудра, не реагируют с водородом при обычных условиях. Это связано с тем, что алюминий образует стабильный оксидный слой на своей поверхности, который предотвращает взаимодействие с водородом.
При нагревании алюминия до очень высокой температуры и наличии катализатора, например платины, возможна реакция металла с водородом. В этом случае образуется алюминиевый гидрид (AlH3), который является сильным водородным донором и может быть использован в качестве хранителя водорода.
Таким образом, алюминий является одним из металлов, оксиды которого не реагируют с водородом при обычных условиях, благодаря стабильной оксидной пленке на его поверхности.
Вопрос-ответ

Какие металлы не реагируют с водородом?
Список металлов, оксиды которых не реагируют с водородом, включает в себя такие элементы, как золото (Au), платина (Pt), серебро (Ag), рутений (Ru), иридий (Ir) и палладий (Pd). Эти металлы имеют очень низкую реактивность и обладают высокой устойчивостью к окислению, поэтому не реагируют с водородом при комнатной температуре и обычных условиях.
Почему оксиды некоторых металлов не реагируют с водородом?
Оксиды некоторых металлов не реагируют с водородом из-за их высокой стабильности и низкой реактивности. Когда металл образует оксид, он связывается с кислородом, образуя стабильную связь. Водород не может заменить кислород в этой связи из-за своей меньшей реактивности. Поэтому оксиды этих металлов не реагируют с водородом.
Как использование металлов, оксиды которых не реагируют с водородом, может быть полезным?
Использование металлов, оксиды которых не реагируют с водородом, имеет несколько преимуществ. Во-первых, эти металлы обладают высокой устойчивостью к окислению, что делает их полезными для изготовления ювелирных изделий, электроники и других предметов, которые должны сохранять свой блеск и качество в течение длительного времени. Во-вторых, такие металлы могут быть использованы в процессе каталитических реакций, где они выступают в качестве катализаторов и ускоряют химические реакции без самостоятельной реакции с водородом.
Есть ли какие-либо исключения в списке металлов, оксиды которых не реагируют с водородом?
В списке металлов, оксиды которых не реагируют с водородом, нет абсолютных исключений. Однако некоторые металлы могут образовывать соединения, которые реагируют с водородом при определенных условиях. Например, железо (Fe) может образовывать реактивные оксиды, которые могут взаимодействовать с водородом при высоких температурах и в присутствии катализаторов. Такие случаи являются исключительными и редкими.
