Амфотерные металлы - это класс веществ, которые могут проявлять свойства и кислот, и оснований. Одним из основных представителей этого класса является алюминий, который обладает широким спектром реакций и находит применение во многих сферах нашей жизни, начиная от промышленности и заканчивая медициной.
Соли амфотерных металлов образуются в результате реакции с кислотой или основанием, при этом демонстрируя различные свойства. Например, алюминиевые соли могут проявлять кислотные свойства, образуя побуревший раствор соединений, а также основные свойства, образуя гидроксид алюминия.
Важно отметить, что реакции амфотерных металлов определяются их электрохимическими свойствами. Алюминий, например, благодаря своей низкой энергии ионизации, охотно донорирует электроны и проявляет основные свойства. Однако, при взаимодействии с кислотой, он способен принять электроны и проявить кислотные свойства, формируя положительно заряженные ионы.
Таким образом, соли амфотерных металлов могут проявлять как кислотные, так и основные свойства в зависимости от условий реакции. Их способность изменять свое поведение является ценным свойством, которое находит применение в различных сферах науки и техники.
В данной статье мы рассмотрим несколько примеров реакций солей амфотерных металлов и обсудим, какие результаты мы можем ожидать от них. Будет рассмотрено взаимодействие солей алюминия с кислотами, основаниями и другими химическими веществами, а также рассмотрены некоторые альтернативные методы получения солей амфотерных металлов.
Реакции солей амфотерных металлов: каковы возможные результаты?

Амфотерные металлы — это элементы, которые могут проявлять как кислотные, так и основные свойства. В реакциях солей амфотерных металлов можно наблюдать разнообразные результаты, в зависимости от условий и реагентов, принимающих участие.
Реакция амфотерного металла с кислотой может привести к образованию соли и выделению водорода. Например, если соль амфотерного металла добавить в разбавленную соляную кислоту, произойдет образование новой соли и выделение водорода.
С другой стороны, реакция амфотерного металла с щелочью может привести к образованию гидроксида металла. Например, если соль амфотерного металла добавить в разбавленный раствор натрия гидроксида, произойдет осаждение гидроксида амфотерного металла.
В некоторых случаях, реакция амфотерного металла может привести к образованию комплексных соединений. Например, если соль амфотерного металла добавить в раствор аммиака, может образоваться амминокомплекс металла.
Также, соли амфотерных металлов могут образовывать комплексы с органическими лигандами, например, с аминокислотами или белками. Это может иметь важное значение для биологических процессов, таких как образование комплексов в организме или влияние металлов на ферментные реакции.
Выводя наши наблюдения в систематическом порядке, можно составить таблицу, где перечислены различные амфотерные металлы, их кислотные и основные свойства, а также возможные результаты их реакций с разными реагентами. Такая таблица поможет систематизировать знания о реакциях амфотерных металлов и предсказать возможные результаты в различных условиях.
Разложение солей амфотерных металлов в водных растворах

Амфотерные металлы - это вещества, которые могут проявлять как кислотные, так и щелочные свойства в растворе. Вода, как известно, является универсальным растворителем, способным диссоциировать практически все химические соединения на ионы. Поэтому соли амфотерных металлов будут разлагаться в водных растворах с образованием соответствующих ионов.
Разложение солей амфотерных металлов происходит благодаря взаимодействию с водой. В результате этого процесса, соль диссоциирует на ионы металла и анионы. Если металл обладает кислотными свойствами, то он будет отдавать воде протоны, образуя гидроксокомплексы. Если же металл обладает щелочными свойствами, он будет принимать протоны от воды, образуя гидроксидные ионы. Таким образом, соли амфотерных металлов при разложении в воде могут образовывать различные гидроксо-комплексы.
Важно отметить, что разложение солей амфотерных металлов в водных растворах может быть ускорено или замедлено изменением pH. Из-за кислотности или щелочности среды, ионы металла могут проявлять разную активность и степень разложения. Например, в кислой среде ионы металла будут давать протоны воде, а в щелочной среде будут принимать протоны от воды. Это значит, что растворы солей амфотерных металлов могут иметь разные свойства в зависимости от pH окружающей среды.
Таким образом, разложение солей амфотерных металлов в водных растворах - это процесс, при котором образуются соответствующие гидроксо-комплексы. Разная активность ионов металла в зависимости от pH окружающей среды позволяют солям амфотерных металлов проявлять разные свойства и реакции в растворе.
Образование осадка при взаимодействии с другими растворами

В реакциях солей амфотерных металлов может происходить образование осадка при взаимодействии с другими растворами, что часто связано с образованием слаборастворимых соединений. Осадок образуется в результате обратной реакции, когда продукты растворения оказываются менее растворимыми, чем исходные соединения.
Например, при реакции соли амфотерного металла с раствором кислоты может образовываться осадок в виде нерастворимого гидроксида металла. Это связано с образованием молекул воды и ионов металла, которые реагируют между собой и образуют осадок гидроксида в результате химической реакции.
Также осадок может образовываться при взаимодействии соли амфотерного металла с раствором щелочи. В этом случае реакция происходит аналогичным образом: ионы металла из исходной соли реагируют с ионами гидроксида из раствора щелочи, образуя осадок гидроксида металла.
В завершение, можно отметить, что образование осадка при взаимодействии с другими растворами в реакциях солей амфотерных металлов зависит от реакционных условий, концентрации реагентов и значения реакционного равновесия. Это является одним из важных аспектов при изучении и применении амфотерных металлов в различных химических процессах.
Проявление кислотно-основных свойств в химических реакциях
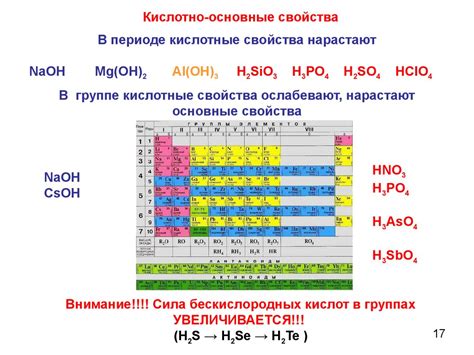
Амфотерные металлы - это вещества, которые могут проявлять как кислотные, так и основные свойства в химических реакциях. Это означает, что они могут реагировать как с кислотами, так и с основаниями, образуя соответствующие соли.
Когда амфотерный металл вступает в реакцию с кислотой, он выступает в качестве основания, принимая на себя протон от кислоты. Таким образом, образуется соль металла и вода. Например, алюминий, который является амфотерным металлом, может реагировать с соляной кислотой:
- Al + HCl → AlCl3 + H2
Однако, когда амфотерный металл вступает в реакцию с основанием, он выступает в качестве кислоты, отдавая протон основанию. В результате образуется соль металла и вода. Например, цинк, который также является амфотерным металлом, может реагировать с гидроксидом натрия:
- Zn + 2NaOH → Na2Zn(OH)4
Таким образом, амфотерные металлы способны проявлять как кислотно-основные свойства в реакциях с кислотами и основаниями. Это делает их важными компонентами в различных химических процессах и приготовлении различных соединений.
Влияние реакции солей на окружающую среду

Реакции солей амфотерных металлов могут оказывать как положительное, так и отрицательное влияние на окружающую среду. В зависимости от условий и конкретной реакции, результаты могут быть разнообразными.
Во-первых, реакции солей амфотерных металлов могут способствовать восстановлению окружающей среды. Некоторые амфотерные металлы, такие как алюминий, могут выполнять роль коагулянтов в процессе очистки воды. Они способны образовывать гидроксидные осадки, которые адсорбируют и выстраивают вредные вещества и загрязнения, таким образом помогая очистке воды.
Однако реакции солей амфотерных металлов также могут негативно влиять на окружающую среду. Например, неконтролируемая утечка или выброс амфотерных металлов, таких как медь или свинец, может привести к загрязнению почвы, воды и воздуха. Они могут образовывать токсичные соединения, которые негативно влияют на растения, животных и людей.
Другим негативным эффектом реакции солей амфотерных металлов является изменение pH. Гидроксидные осадки, образующиеся в результате этих реакций, могут повысить или понизить pH водной среды, что может негативно отразиться на живых организмах и экосистеме в целом.
Итак, влияние реакций солей амфотерных металлов на окружающую среду зависит от условий, конкретной реакции и специфических характеристик металла. Необходимо контролировать и регулировать данные реакции, чтобы минимизировать их негативное воздействие и максимизировать их положительный эффект на окружающую среду.
Вопрос-ответ

Какие металлы могут быть амфотерными?
Амфотерными металлами являются те, которые могут проявлять свойства кислот и оснований в зависимости от условий реакции. К ним относятся, например, алюминий, цинк, свинец, железо и др.
Что происходит со солями амфотерных металлов при реакции с кислотами?
Солям амфотерных металлов при взаимодействии с кислотами происходит нейтрализационная реакция, в результате которой образуется соль и обычно выделяется вода. Эти металлы действуют как основания, принимая на себя ион водорода от кислоты.
Какие реакции могут происходить между солями амфотерных металлов и основаниями?
При взаимодействии солей амфотерных металлов с основаниями могут происходить различные реакции. Например, нейтрализационная реакция, при которой образуется соль и обычно выделяется вода. Также могут происходить реакции гидролиза, при которых соли разлагаются на кислоту и основание.
Могут ли соли амфотерных металлов проявлять свойства окислителей или восстановителей?
Да, соли амфотерных металлов могут проявлять свойства и окислителей, и восстановителей. Это связано с их способностью изменять свою степень окисления в зависимости от условий реакции. Например, алюминий может вступать и в окислительные, и в восстановительные реакции.
Какие свойства проявляют амфотерные металлы при реакции с водой?
Амфотерные металлы реагируют с водой и проявляют свойства как оснований, так и кислот. Они способны как принимать на себя ионы водорода из воды (как основания), так и отдавать ионы гидроксидного иона (как кислоты). Например, алюминий при реакции с водой образует гидроксид алюминия и выделяет водород.
