Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают особым свойством - активностью в химических реакциях. Активность этих металлов объясняется их низкой электроотрицательностью, что позволяет им эффективно реагировать с другими веществами.
Реакция щелочей активных металлов с водой - одна из наиболее известных реакций, проявляющая особенности активных металлов. При контакте с водой, щелочи активных металлов превращаются в основания, такие как окиси или гидроксиды металлов. Так, литий реагирует с водой, образуя гидроксид лития (LiOH) и выделяя водород (H2). Реакция натрия с водой также сопровождается выделением водорода и образованием гидроксида натрия (NaOH).
Что касается реакции калия с водой, она происходит самым активным образом. В результате реакции образуются гидроксид калия (KOH) и выделяется большое количество водорода, что сопровождается характерными хлопками. Реакция калия с водой является самой яркой и специфической из всех реакций щелочных металлов с водой.
Важно отметить, что реакции щелочных металлов с водой являются экзотермическими, то есть сопровождаются выделением тепла. Это свидетельствует о высокой активности металлов, а также может стать причиной возгорания взаимодействующих веществ, особенно в случае с калием.
Щелочные металлы: химические свойства и активность

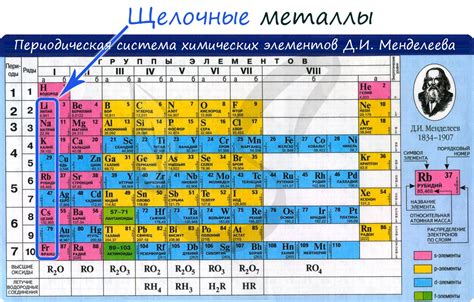
Щелочные металлы представляют собой группу элементов, которые находятся в первой группе периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом химических свойств, которые делают их уникальными и очень активными.
Одной из основных характеристик щелочных металлов является их способность реагировать с водой. При контакте с водой эти металлы образуют щелочные растворы, выделяя водород. Реакция проходит очень интенсивно, иногда с высвобождением значительного количества энергии. Например, натрий проникает в воду с шипением и хлопком, образуя горячий раствор натриевой гидроксида. Подобные реакции между щелочными металлами и водой часто называются "взрывоопасными".
Щелочные металлы могут также реагировать с кислородом. Они активно окисляются воздухом, превращаясь в оксиды или пероксиды. Например, литий со временем погруженный в воздух покрывается тонким слоем оксида. Это объясняет, почему щелочные металлы, особенно литий, часто хранят в масле или гексане для предотвращения их окисления.
Активность щелочных металлов связана с тем, что они имеют одну валентную электронную оболочку. Эта оболочка очень слабо притягивается ядром атома, что делает металлы очень реакционноспособными. Таким образом, щелочные металлы легко отдают свой электрон и образуют положительные ионы, что объясняет их способность образовывать сильные щелочные соединения с кислородом, серой, азотом и другими неметаллами.
Щелочные металлы: взаимодействие с водой и кислородом
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают высокой реактивностью и способны взаимодействовать с водой и кислородом.
При контакте с водой щелочные металлы проявляют активную реакцию, которая сопровождается выделением водорода (H2). В результате этой реакции образуется щелочные гидроксиды, такие как гидроксид лития (LiOH), гидроксид натрия (NaOH) и гидроксид калия (KOH). Эти вещества способны образовывать щелочные растворы, которые имеют высокий pH и характеризуются щелочными свойствами.
Взаимодействие щелочных металлов с кислородом происходит при нагревании металла в присутствии воздуха. При этом образуются оксиды металлов, такие как оксид лития (Li2O), оксид натрия (Na2O) и оксид калия (K2O). Эти оксиды являются щелочными и способны реагировать с влагой, образуя гидроксиды.
Реакции щелочных металлов с водой и кислородом являются характерными для этой группы элементов. Они обусловлены высокой активностью щелочных металлов, которая проявляется в их стремлении образовать стабильные соединения и производить выделение водорода. Эти реакции имеют практическое применение, например, в батареях и аккумуляторах, а также в производстве гидроксидов и оксидов металлов.
Использование щелочных металлов в промышленности и научных исследованиях
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, широко применяются в различных отраслях промышленности и научных исследованиях благодаря своим уникальным свойствам и активности.
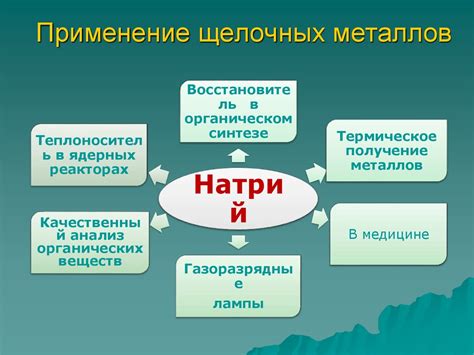
Одной из основных областей применения щелочных металлов является производство аккумуляторов. Литий-ионные аккумуляторы на основе лития, например, применяются в электронике, автомобильной промышленности и солнечных батареях. Натрий-сероводородные аккумуляторы на основе натрия используются для хранения электроэнергии с возможностью масштабирования. Калиевые аккумуляторы также находят применение в сфере энергетики и экологии.
Щелочные металлы используются в качестве катализаторов и веществ, изменяющих структуру поверхности материала. Они применяются в процессах синтеза органических соединений, в качестве катализаторов при производстве пищевых добавок и фармацевтических препаратов. Более того, щелочные металлы могут быть использованы в качестве веществ, изменяющих свойства жидких кристаллов, используемых в компьютерных мониторах, телевизорах и других устройствах.
Щелочные металлы также нашли применение в промышленной пиротехнике и производстве зажигательных смесей. Натрий и калий способны давать яркие пламенные реакции, их соединения используются для создания вспышек, фейерверков и сигнальных ракет.
В научных исследованиях щелочные металлы используются для создания нагруженных легкими сплавами, которые имеют высокую прочность и малый вес. Они используются для создания конструкционных материалов, а также в области космических исследований и авиации для уменьшения веса и повышения энергоэффективности. Благодаря своим уникальным свойствам, щелочные металлы также применяются в области ядерной энергетики и производства радиоактивных источников энергии.
В целом, использование щелочных металлов в промышленности и научных исследованиях является неотъемлемой частью современных технологий и имеет большой потенциал в различных отраслях, от электроники и энергетики до пиротехники и космических исследований.
Вопрос-ответ

Что такое активные металлы?
Активные металлы - это элементы, которые легко реагируют с другими веществами, особенно с кислородом и водой. Они обладают высокой реакционной способностью и низкой электронной аффинностью.
Какие щелочи считаются активными металлами?
Как правило, к активным металлам относятся щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы имеют наиболее низкую электроотрицательность среди всех элементов, что делает их очень реакционноспособными.
Какую активность имеют щелочи активных металлов?
Щелочи активных металлов обладают высокой активностью. Они легко реагируют с кислородом, водой и кислотами, образуя соответствующие соли. Реакции могут быть сильно экзотермическими и сопровождаться выделением большого количества тепла и газов.
Почему щелочи активных металлов реагируют с водой?
Реакция щелочей активных металлов с водой обусловлена их высокой реакционной способностью и свойством образовывать гидроксиды. При контакте с водой, активные металлы активно окисляются, отдавая электроны и образуя гидроксиды. Эта реакция и делает щелочные металлы такими реакционноспособными.
Какие особенности имеют реакции щелочей активных металлов?
Реакции щелочей активных металлов имеют несколько особенностей. Во-первых, они экзотермические, то есть сопровождаются выделением тепла. Во-вторых, при взаимодействии с водой образуется щелочь, которая является сильным основанием. Кроме того, такие реакции могут протекать с выделением гидрогена и образованием гидроксидов активных металлов.
