Активность металлов в химических реакциях зависит от различных факторов, которые могут значительно влиять на ход реакции и кинетику процесса. Одним из главных факторов, способствующих увеличению активности металлов, является их электронная конфигурация.
Металлы имеют свободные электроны в своей внешней оболочке, которые могут легко участвовать в химических реакциях. Чем больше свободных электронов у металла, тем более активным он является. Это объясняется тем, что свободные электроны обладают отрицательным зарядом и могут легко передаваться другим атомам, образуя ионные связи или металлические соединения.
Кроме того, увеличение активности металлов может быть обусловлено их положением в периодической системе элементов. Например, металлы первой группы (щелочные металлы), такие как натрий и калий, очень активны, поскольку они имеют только один свободный электрон во внешней оболочке. Этот электрон легко отдается, образуя ион с положительным зарядом.
Также важным фактором, который способствует увеличению активности металлов, является их чистота и степень оксидации. Чем чище и меньше окислен металл, тем больше свободных электронов он имеет и тем активнее он будет в химических реакциях. Поэтому, для повышения активности металлов, часто используется метод очистки и специальная обработка поверхности.
Влияние температуры на активность металлов

Температура играет важную роль в активности металлов и может оказывать разнообразное влияние на их химические свойства. Повышение температуры обычно приводит к увеличению активности металлов.
На молекулярном уровне, повышение температуры увеличивает энергию частиц, что может привести к интенсификации химических реакций. Увеличение температуры может ускорить реакцию окисления металлов, что приводит к образованию оксидов металлов.
Также, повышение температуры может способствовать переходу металлов в более активную форму. Например, при нагревании железо может превратиться в горячую, пластичную массу, что делает его более реакционноспособным.
Однако, следует отметить, что существуют пределы, когда температура может стать препятствием для активности металлов. Высокая температура может спровоцировать распад соединений, что в свою очередь может привести к потере активности металлов. Поэтому, контроль температуры при работе с металлами является важным при способствовании их активности и эффективности.
Роль теплоты в процессе окисления

Теплота играет важную роль в процессе окисления металлов. Окисление представляет собой химическую реакцию, в которой металл вступает в реакцию с кислородом из воздуха. При этом выделяется теплота.
Выделяющаяся теплота является фактором, способствующим увеличению активности металлов. Обычно увеличение активности металла приводит к его более интенсивному окислению. Это связано с тем, что выделение теплоты в процессе окисления способствует ускорению химической реакции.
Теплота позволяет повысить энергию активации реакции окисления, что приводит к увеличению скорости процесса. Выделение теплоты усиливает движение атомов и молекул, способствуя более активному взаимодействию металла с кислородом.
Однако в некоторых случаях теплота может также оказывать обратное влияние на процесс окисления. Выделение большого количества теплоты может привести к повышению температуры, что может значительно замедлить процесс окисления из-за увеличения энергетического барьера.
Таким образом, теплота играет важную роль в процессе окисления металлов, способствуя увеличению их активности. Однако необходимо учитывать, что эксцессивное выделение теплоты может привести к обратным эффектам и замедлению процесса окисления.
Увеличение скорости реакции при повышении температуры

Одним из факторов, способствующих увеличению активности металлов, является повышение температуры.
При повышении температуры молекулярная кинетическая энергия возрастает, что приводит к ускорению скорости химических реакций. Взаимодействие металлов с окружающей средой, такое как окисление или растворение, происходит быстрее при более высоких температурах.
Высокая температура способствует разрушению связей в металлической решетке и позволяет электронам свободно передвигаться, что облегчает электронный обмен с окружающими веществами. Это приводит к более интенсивной реакции металла с окислителем, что обычно указывает на повышенную активность металла.
Повышение температуры также может способствовать расширению решетки металла, что увеличивает доступность активных центров реакции и повышает вероятность столкновений с реагентами. Это дополнительно увеличивает скорость реакции и активность металла.
Тем самым, увеличение температуры является одним из важных факторов, влияющих на активность и скорость реакций металлов. Это объясняется повышенной энергией активации и улучшенными условиями для взаимодействия металлических частиц с окружающей средой.
Влияние кислотности на активность металлов

Кислотность является одним из важных факторов, влияющих на активность металлов. Она определяет способность металла образовывать положительные ионы в растворе.
Большинство металлов проявляют активность в кислых условиях, где содержание положительных ионов в растворе достаточно высоко. Такие металлы, как железо, цинк и алюминий, реагируют с кислотой, образуя соли и выделяя водород.
Однако некоторые металлы проявляют активность только в некислых или щелочных растворах. Например, натрий и калий реагируют с водой только в щелочной среде.
Кроме того, кислотность может влиять на скорость реакции металла с кислотой. Чем более кислотное растворение, тем быстрее протекает реакция и металл активнее.
Таким образом, кислотность играет важную роль в активности металлов, определяя их способность реагировать с другими веществами и образовывать ионы в растворе.
Важность pH-уровня для реакции с металлами
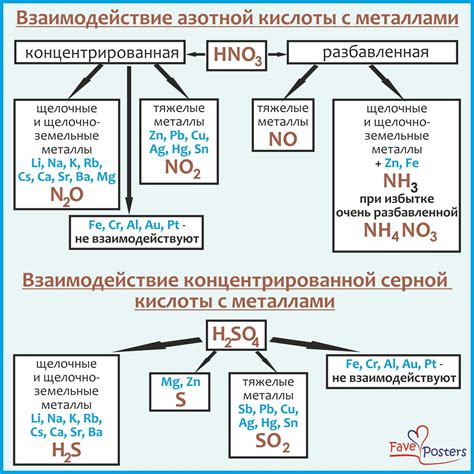
pH-уровень играет важную роль в процессе реакции металлов с другими веществами. Он определяет химическую активность металлов и может значительно влиять на скорость и направление реакции.
Низкий pH-уровень, т.е. кислая среда, облегчает реакцию с металлами. Кислоты могут образовывать ионы водорода, которые взаимодействуют с поверхностью металла, вызывая его диссоциацию и образование соответствующего иона металла. Это явление называется коррозией металла и может привести к его разрушению.
Наоборот, высокий pH-уровень, т.е. щелочная среда, может замедлить или остановить реакцию с металлами. Высокая концентрация гидроксидных ионов, образующихся в щелочной среде, может уменьшить доступность поверхности металла для взаимодействия с другими веществами и, таким образом, снизить активность металла.
Важно отметить, что каждый металл имеет свой оптимальный pH-уровень для реакции. Например, алюминий и цинк активно реагируют в кислой среде, медь и железо - в слабощелочной среде, а некоторые редкие металлы имеют свои специфические условия реакции.
Поэтому при работе с металлами необходимо учитывать pH-уровень среды, чтобы обеспечить оптимальные условия для реакции и избежать нежелательной коррозии или замедления процесса.
Коррозия и ее связь с кислотностью

Коррозия – это процесс разрушения и повреждения металлов вследствие их взаимодействия с окружающей средой. Один из факторов, влияющих на скорость коррозии, это кислотность среды, с которой контактирует металл. Кислотность изменяет скорость окисления металла и может ускорять или замедлять процесс коррозии.
Когда металл контактирует с кислотной средой, происходит реакция окисления, в результате чего на поверхности металла образуется оксидная пленка. Кислотность среды влияет на скорость образования этой пленки. В кислой среде образование оксидной пленки происходит быстрее, что ускоряет процесс коррозии. Если оксидная пленка удаляется или повреждается, металл становится более подвержен коррозии.
Кроме того, кислотность влияет на растворимость оксидов металлов, что также может влиять на скорость коррозии. В некоторых случаях, в кислых условиях металл может растворяться, ускоряя процесс коррозии.
Однако, не все металлы одинаково реагируют на кислотность среды. Некоторые металлы, такие как нержавеющая сталь или алюминий, образуют защитную пленку, которая предотвращает коррозию. Эта пленка может быть устойчивой к кислотности среды и предотвращать дальнейшее окисление металла.
Роль влажности в активности металлов

Влажность является одним из основных факторов, влияющих на активность металлов. Она может способствовать как повышению, так и снижению этой активности в зависимости от условий.
Влажность воздуха является наиболее распространенным и важным источником влаги для металлов. Когда металлы находятся во влажной среде, вода может вступать в реакцию с их поверхностью, вызывая коррозию. Коррозия приводит к разрушению металла и уменьшению его активности.
Однако, некоторые металлы, такие как натрий, калий и литий, могут выделяться в виде гидроксидных и гидразидных соединений при контакте с влажностью. Это способствует повышению активности этих металлов и возможности их использования в различных химических реакциях.
Также влажность влияет на реакционную способность металлов в других окружающих средах. Например, влажность почвы может повышать растворимость металлов, что увеличивает вероятность их взаимодействия с растениями и другими организмами.
Таким образом, влажность играет важную роль в активности металлов, влияя как на их коррозионные свойства, так и на реакционную способность в различных средах. Понимание этого фактора позволяет более точно контролировать и использовать металлы в различных областях науки и техники.
Вопрос-ответ

Почему металлы проявляют активность?
Металлы проявляют активность из-за их внутренней структуры и электронной конфигурации, которая способствует образованию ионов положительного заряда.
Какие факторы могут увеличить активность металлов?
Активность металлов может увеличиваться под влиянием таких факторов, как повышение температуры, взаимодействие с кислородом, наличие катализаторов или образование сплавов с другими металлами.
Почему повышение температуры способствует увеличению активности металлов?
Повышение температуры обычно увеличивает энергию реакций и ускоряет процессы окисления металлов, поэтому активность металлов может увеличиваться при повышении температуры.
Как взаимодействие металлов с кислородом влияет на их активность?
Взаимодействие металлов с кислородом может привести к образованию оксидов металлов, что увеличивает их активность. Кислород может выступать в качестве окислителя и способствовать окислительно-восстановительным реакциям.
Что такое катализаторы и как они влияют на активность металлов?
Катализаторы – это вещества, которые ускоряют химические реакции, но не изменяются при этом сами. Некоторые катализаторы могут увеличивать активность металлов, обеспечивая более эффективное взаимодействие с другими веществами и увеличение скорости реакций.
