Стандартный потенциал металла является одним из наиболее важных параметров при изучении его химического поведения. Понимание стандартных потенциалов металлов позволяет определить их тенденцию к окислению или восстановлению, а также реакционную способность в различных условиях.
Стандартный потенциал металла определяет его способность отдавать или принимать электроны в электрохимических реакциях. Этот параметр измеряется в относительных величинах и определяет, какая реакция будет происходить на электроде данного металла. Металлы с положительным стандартным потенциалом имеют большую склонность к окислению, то есть отдаче электронов, в то время как металлы с отрицательным стандартным потенциалом имеют большую склонность к восстановлению, то есть принятию электронов.
Знание стандартных потенциалов металлов важно для множества практических применений, например, при выборе материалов для использования в электрохимических процессах, системах с ионными переносчиками или при изучении причин коррозии. За счет разницы в стандартных потенциалах металлов возникает потенциальная разница между ними, что может привести к электрохимическим процессам, таким как гальваническая коррозия, которая может серьезно повлиять на долговечность и надежность металлических изделий и конструкций.
Определение стандартных потенциалов металлов
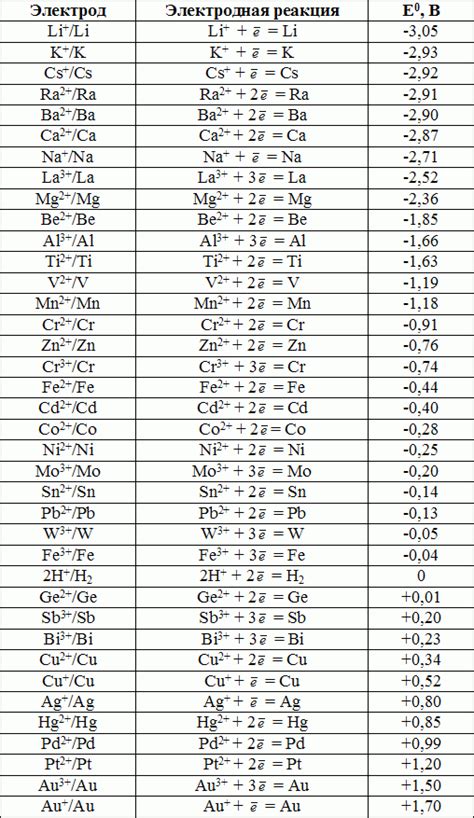
Стандартный потенциал металла - это характеристика его способности вступать в реакцию окисления или восстановления в сравнении с некоторым стандартным электродом. У каждого металла есть свой стандартный потенциал, который может быть положительным, отрицательным или равным нулю.
Стандартные потенциалы металлов измеряются относительно стандартного водородного электрода. Для удобства сравнения металлов величины стандартных потенциалов приводятся в таблице, где они упорядочены по возрастанию или убыванию.
Стандартные потенциалы металлов позволяют оценить их химическую активность и способность к коррозии. Металлы с более высокими стандартными потенциалами обычно более устойчивы к коррозии, так как они легче вступают в реакцию окисления. Наоборот, металлы с более низкими стандартными потенциалами более активны и склонны к коррозии.
Знание стандартных потенциалов металлов важно при выборе материалов для различных конструкций и в процессе защиты металлических поверхностей от коррозии. Также они находят применение в электрохимии, где используются для проведения электролиза и других электрохимических процессов.
Факторы, влияющие на стандартные потенциалы металлов
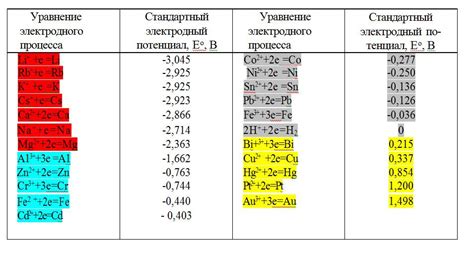
Химический состав: Одним из основных факторов, влияющих на стандартные потенциалы металлов, является их химический состав. Различные металлы имеют разные электрохимические свойства и способность взаимодействовать с растворами и ионами. Например, металлы, обладающие более высокой реактивностью, будут иметь более низкие стандартные потенциалы.
Окружающая среда: Среда, в которой находится металл, также оказывает влияние на его стандартный потенциал. Электрохимические реакции могут происходить в различных растворах или газах, которые могут оказывать как катодное, так и анодное действие на металлы. Например, окружающая среда может содержать окислители или вещества, способные образовывать комплексы с металлами, что может изменить их потенциалы.
Температура: Температура окружающей среды или самого металла может влиять на его электрохимические свойства и, соответственно, на его стандартный потенциал. При повышении температуры скорость электрохимических реакций может увеличиваться, что может привести к изменению потенциала металла.
Чистота металла: Стандартные потенциалы металлов также зависят от их чистоты. Примеси в металлах могут влиять на их электрохимические свойства и потенциалы. Чем чище металл, тем более надежные и точные будут значения его стандартного потенциала.
Размер и форма: Размер и форма металла также могут влиять на его стандартный потенциал. Например, в случае электрической контактной разницы потенциалов, большой размер металла может привести к более низкому потенциалу, чем у металла меньшего размера. Форма металла также может оказывать влияние на его поверхностные свойства и способность к электрохимическим реакциям.
Значение стандартных потенциалов металлов в химических реакциях
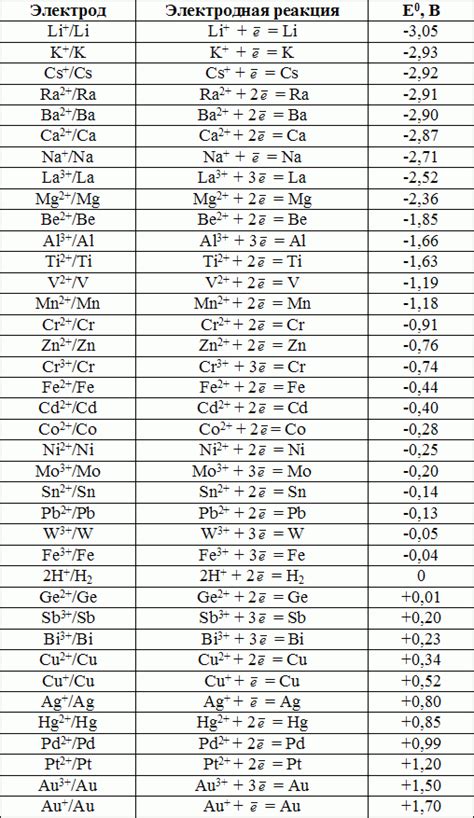
Стандартный потенциал металла - это величина, которая характеризует способность данного металла вступать в окислительно-восстановительные реакции. Она измеряется в вольтах и показывает, насколько данное вещество способно передавать или получать электроны при проведении реакций.
Значение стандартного потенциала металла играет важную роль во многих химических реакциях. По этой величине можно определить, будет ли данный металл окисляться или восстанавливаться в химической реакции. Если значение стандартного потенциала положительно, то металл является хорошим восстановителем и будет способен передавать электроны другим веществам. В случае отрицательного значения потенциала, металл будет восстанавливаться а не окисляться.
Значение стандартного потенциала металла также позволяет определить, какой металл является сильнее окислителем, а какой - восстановителем в данной реакции. Если стандартный потенциал одного металла выше, чем у другого, то первый окислит второй. Уравнения окислительно-восстановительных реакций можно составить на основе сравнения значений стандартных потенциалов металлов.
Значение стандартного потенциала металла также влияет на реакции коррозии. Чем выше стандартное потенциал металла, тем он более активен и подвержен коррозии. Благодаря этому свойству некоторых металлов, таких как железо или алюминий, они могут использоваться в качестве анодов при создании гальванических элементов или батарей.
Стандартные потенциалы металлов и их применение в электрохимии
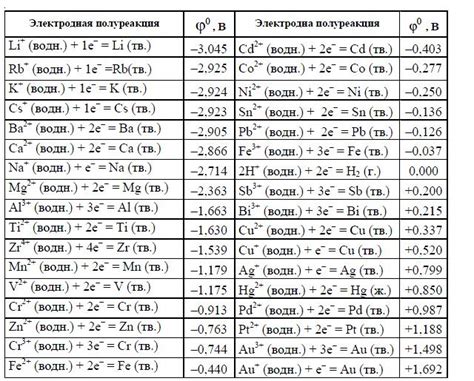
Стандартные потенциалы металлов – это величины, показывающие их способность окисляться или восстанавливаться в сравнении с некоторой стандартной электродной полуячейкой. Они являются важным инструментом в электрохимии и находят широкое применение в различных областях.
Стандартные потенциалы металлов позволяют оценить термодинамическую спонтанность химических реакций, происходящих на электродах, а также определить потенциалы электродных полуячеек и направление течения электрического тока. Они используются, например, в гальванических элементах, электролизе и других методах электрохимического анализа.
Сравнительная таблица стандартных потенциалов металлов помогает оценить их активность в реакциях окисления-восстановления. Металлы с более высокими потенциалами окисления обладают большей активностью, так как легче отдают электроны и окисляются, тогда как металлы с более низкими потенциалами окисления имеют меньшую активность и более трудно окисляются.
Зная стандартные потенциалы металлов, можно предсказать, какие металлы могут быть использованы в качестве анодов или катодов в электрохимических процессах. Например, металл с более высоким стандартным потенциалом может служить анодом, а с меньшим потенциалом – катодом. Это позволяет создавать эффективные гальванические элементы и электролитические ячейки.
Сравнение стандартных потенциалов металлов
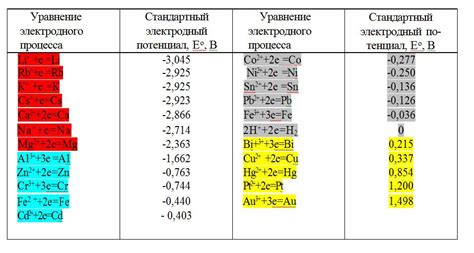
Стандартный потенциал металла - это величина, характеризующая его способность отдавать или принимать электроны. Чем выше значение стандартного потенциала металла, тем больше он склонен отдавать электроны и тем более активным является в химических реакциях.
При сравнении стандартных потенциалов металлов важно учитывать, что они определены при определенной температуре и концентрации ионов. Также нужно учитывать, что значение стандартного потенциала может меняться в различных окружающих условиях.
По сравнению стандартных потенциалов металлов можно провести строительную эквивалентность и ряд активности металлов, который позволяет судить о вероятности различных электрохимических реакций. Вы можете найти таблицу сравнения стандартных потенциалов металлов, в которой представлены значения для различных пар металлов.
Например:
- Металл А имеет стандартный потенциал -0.5 В, а металл Б имеет стандартный потенциал -0.2 В. Таким образом, металл А более активен, чем металл Б, и будет склонен отдавать электроны в реакциях с металлом Б.
- Металл В имеет стандартный потенциал +0.4 В, а металл Г имеет стандартный потенциал +0.8 В. Таким образом, металл Г более активен, чем металл В, и будет склонен отдавать электроны в реакциях с металлом В.
Сравнение стандартных потенциалов металлов позволяет прогнозировать и предсказывать химические реакции, а также определить возможность возникновения электрохимических процессов, таких как коррозия и гальванические элементы.
Классификация металлов по их стандартным потенциалам
Металлы могут быть классифицированы в соответствии со своими стандартными потенциалами, которые отражают их способность вступать в электрохимические реакции. Стандартный потенциал металла показывает, сколько энергии требуется, чтобы перевести его из вещества вида иона со знаком "+" во вещество вида иона со знаком "-".
Выделяют два основных класса металлов: активные и пассивные. Активные металлы имеют отрицательные стандартные потенциалы и легко окисляются, выделяя электроны. Пассивные металлы, наоборот, имеют положительные стандартные потенциалы и обладают высокой устойчивостью к окислению.
Примеры активных металлов включают цинк, железо, алюминий и магний. Они способны вступать в реакции с кислородом, образуя оксиды и гидроксиды. Такие металлы широко используются в производстве материалов и конструкций, так как обладают хорошей коррозионной стойкостью.
Пассивные металлы, например, платина, золото, серебро и титан, обладают высокими стандартными потенциалами и образуют защитную покрытие оксидами на поверхности. Это делает их устойчивыми к коррозии и позволяет применять в различных отраслях, включая химическую, медицинскую и электронную промышленности.
Таблица позволяет лучше увидеть классификацию металлов по их стандартным потенциалам:
| Классификация | Примеры |
|---|---|
| Активные металлы | Цинк, железо, алюминий, магний |
| Пассивные металлы | Платина, золото, серебро, титан |
Знание стандартных потенциалов металлов невероятно важно для понимания их электрохимического поведения и возможности их применения в различных областях науки и техники.
Значение стандартных потенциалов металлов в коррозии
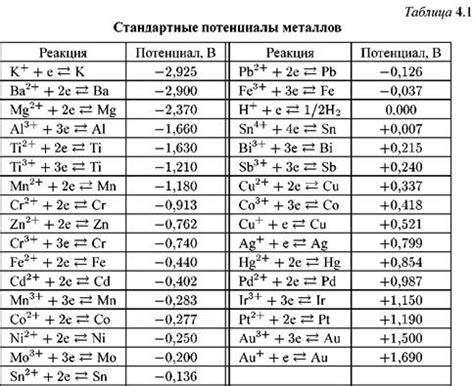
Стандартный потенциал металла является важным показателем его тенденции к коррозии. Он определяет потенциал, при котором металл будет терять электроны и превращаться в ионы в агрессивной среде.
Знание стандартных потенциалов металлов необходимо для определения и контроля коррозионных процессов. Они позволяют классифицировать металлы по их реактивности и предсказывать их поведение в различных средах.
Стандартные потенциалы металлов можно найти в специальных таблицах. По ним видно, какой металл будет активным (имеет положительный потенциал) и какой будет пассивным (имеет отрицательный потенциал).
Металлы с более положительными потенциалами, такие как золото и платина, имеют большую устойчивость к коррозии, в то время как металлы с более отрицательными потенциалами, такие как цинк и железо, имеют большую склонность к коррозии.
Знание значений стандартных потенциалов металлов позволяет выбирать подходящие материалы для конкретных условий эксплуатации и принимать меры по защите от коррозии, такие как использование анодной защиты или антикоррозионных покрытий.
Изменение стандартных потенциалов металлов в различных условиях

Стандартные потенциалы металлов являются важными характеристиками, которые позволяют оценить их способность к окислению или восстановлению во время реакций с другими веществами. Однако, стоит отметить, что эти потенциалы могут изменяться в зависимости от условий, в которых происходят реакции.
Первый фактор, влияющий на изменение стандартных потенциалов металлов, - это температура. При повышении температуры, активность металла может возрасти, а значит и его потенциал может измениться. В результате это может повлиять на химические реакции, в которых участвуют данные металлы.
Другой фактор, который может оказывать влияние на стандартные потенциалы металлов - это концентрация растворов, в которых протекают реакции. При изменении концентрации окружающих металл ионов в растворе, их активность может измениться, что в свою очередь приведет к изменению стандартного потенциала металла.
Также, стандартные потенциалы металлов могут изменяться в зависимости от pH окружающей среды. Уровень кислотности или щелочности раствора может влиять на активность металла и его способность принимать или отдавать электроны. Поэтому, при изменении pH, изменяются и стандартные потенциалы металлов.
Кроме того, на стандартные потенциалы металлов может влиять и их структура. Некоторые металлы имеют различные кристаллические модификации, которые также могут влиять на активность металла и его потенциал. Например, решеточная структура металла может обеспечить более удобное место для протекания электрохимических реакций.
В целом, изменение стандартных потенциалов металлов в различных условиях связано с изменением их активности и способности реагировать с другими веществами. Понимание этих изменений позволяет более точно предсказывать химические реакции и использовать металлы в различных областях науки и техники.
Вопрос-ответ

Что такое сводка стандартных потенциалов металлов?
Сводка стандартных потенциалов металлов - это перечень значений стандартных потенциалов окисления или восстановления различных металлов. Она позволяет определить, какой из металлов будет более активным при реакции окисления или восстановления.
Зачем нужна сводка стандартных потенциалов металлов?
Сводка стандартных потенциалов металлов необходима для определения направления электрохимических процессов, связанных с окислением и восстановлением металлов. Она позволяет предсказывать, какие металлы могут быть окислены или восстановлены при воздействии на них электролитов или других веществ.
Какие данные содержит сводка стандартных потенциалов металлов?
Сводка стандартных потенциалов металлов содержит значения стандартных потенциалов окисления или восстановления различных металлов. Величины стандартных потенциалов указываются относительно водородного электрода, который имеет нулевой стандартный потенциал.
Какое значение имеет стандартный потенциал металла?
Стандартный потенциал металла - это мера его способности к окислению или восстановлению. Чем выше значение стандартного потенциала, тем более активным является металл и тем легче он окисляется. Напротив, металлы с низкими значениями стандартного потенциала имеют меньшую активность и тяжелее окисляются.
Как можно использовать сводку стандартных потенциалов металлов?
Сводка стандартных потенциалов металлов позволяет определить, какие металлы окисляются или восстанавливаются при реакциях с окружающей средой. Она используется в электрохимических процессах, при проектировании электрохимических элементов и при выборе металлов для различных научных и технических целей.
