Ряд напряжения металлов – это важная информация, которая поможет студентам успешно справиться с заданиями на Едином государственном экзамене. Ряд напряжения металлов отображает их склонность к окислительно-восстановительным реакциям, то есть их способность отдавать или принимать электроны при взаимодействии с другими реагентами. Знание ряда напряжения металлов позволяет предсказывать направление и силу реакций, что особенно важно при выполнении химических расчетов.
Основой для составления ряда напряжения металлов является стандартный водородный электрод, который имеет нулевой потенциал. Остальные элементы располагаются в порядке убывания их степени окисления, причем самые активные металлы находятся в начале таблицы, а самые пассивные – в конце. Применение ряда напряжения металлов позволяет определить, какие металлы будут дисплазировать и выделяться в виде осадка, а какие будут растворяться при проведении электролиза или других реакций.
Напряжение металлов – важный параметр, который влияет на их химическое поведение и реакционную способность. Знание ряда напряжения металлов позволяет предсказывать результаты химических реакций и оптимально подбирать условия проведения экспериментов. При подготовке к Единому государственному экзамену важно усвоить эту информацию и научиться применять ее на практике.
Ряд напряжения металлов

Ряд напряжения металлов – это упорядоченный список металлов по их способности образовывать ионы металла в растворе. Металлы в ряду располагаются таким образом, что более активные металлы обладают большей способностью окислять более пассивные металлы. Ряд напряжения металлов является базовым понятием в химии и находит широкое применение при изучении реакций веществ.
В ряде напряжения металлов, вначале располагаются самые активные металлы, такие как литий, натрий, калий и кальций. Они обладают высокой электроотрицательностью, что позволяет им легко отдавать электроны и образовывать катионы. Более пассивные металлы, такие как железо, медь, цинк и свинец, располагаются в середине ряда.
Использование ряда напряжения металлов позволяет определить, какие металлы могут вытеснить друг друга из растворов и осуществлять окислительно-восстановительные реакции. Например, медь может вытеснить ионы серебра из раствора серебряного нитрата, так как медь является более активным металлом. На основе ряда напряжения металлов также можно определить направление потенциала окисления и восстановления металла в электрохимических реакциях.
Ряд напряжения металлов не только важен для практического применения, но и помогает понять основные закономерности в химии металлов. Изучение этого ряда позволяет более полно осознавать процессы окисления и восстановления, а также образование и реакции металлических ионов в различных условиях.
Список металлов, отсортированных по ряду напряжения

Ряд напряжения металлов представляет собой таблицу, в которой перечислены металлы в порядке возрастания их потенциала гальванической окисления. Чем выше в ряду находится металл, тем сильнее его окислительные свойства. Поэтому при контакте двух металлов из ряда напряжения может возникать разность потенциалов и, следовательно, ток.
Список металлов, отсортированный по ряду напряжения, начинается с самого активного металла – лития (Li), и заканчивается самым пассивным – золотом (Au). По мере продвижения по ряду, увеличивается потенциал гальванической окисления металлов. Важно отметить, что ряд напряжения металлов может меняться в зависимости от условий окружающей среды, температуры и других факторов.
Приведем некоторые примеры металлов, упорядоченных по ряду напряжения:
- Литий (Li)
- Калий (K)
- Кальций (Ca)
- Железо (Fe)
- Никель (Ni)
- Медь (Cu)
- Серебро (Ag)
- Золото (Au)
Используя ряд напряжения металлов, можно прогнозировать, как будет протекать процесс анодной коррозии металлов, а также выбирать правильные материалы для проведения гальванических покрытий или создания элементов электрохимических судов. Кроме того, ряд напряжения металлов широко применяется в гальванической серии для определения электролитического ряда активности металлов.
Как использовать ряд напряжения металлов при решении задач на ЕГЭ
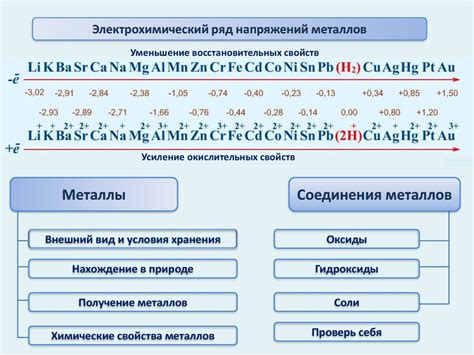
Ряд напряжения металлов – это таблица, которая отображает упорядоченный список металлов по их склонности к окислению или восстановлению в реакциях. Использование ряда напряжения металлов в задачах на ЕГЭ позволяет определить, какая реакция между металлами может произойти.
Чтобы использовать ряд напряжения металлов при решении задач, сначала необходимо определить возможные полуреакции окисления и восстановления. Возникающая реакция может быть полностью написана с учетом балансировки, чтобы определить конечные продукты.
Ориентируясь на ряд напряжения, можно определить, какой металл окисляется, а какой восстанавливается. Металл, находящийся выше в ряду напряжения, будет окисляться, а металл ниже – восстанавливаться.
При решении задач на ЕГЭ, связанных с реакциями металлов, ряд напряжения помогает определить, какие ионы металлов могут взаимодействовать между собой и какие соединения будут образовываться.
Если металл с высоким потенциалом окисления находится в растворе в виде свободного элемента, он будет окислять другие металлы с низким потенциалом окисления. Это знание может быть использовано для определения степени реактивности различных металлов.
Полный список металлов с их напряжениями для подготовки к ЕГЭ по химии
Подготовка к ЕГЭ по химии требует не только знания химических процессов и реакций, но и умения работать с физико-химическими свойствами элементов. Одним из важных понятий в химии является ряд напряжений металлов, который определяет возможность их окисления или восстановления. В данной статье представлен полный список металлов с их напряжениями, которые необходимо знать при подготовке к экзамену.
Список металлов с их напряжениями представлен в порядке убывания значений. Этот список является основой для определения возможности протекания электрохимических реакций. Металлы, находящиеся выше в ряду, имеют большую способность восстанавливать другие металлы или ионы, находящиеся ниже в ряду.
Самым активным металлом является литий, у которого самое низкое значение напряжения (-3,04 В). Далее следуют другие щелочные металлы (натрий, калий), магний, алюминий и т. д. Серебро и золото, напротив, являются малоактивными металлами и имеют высокие значения напряжения (+0,80 В и +1,50 В соответственно).
Знание ряда напряжений металлов позволяет предсказать, какие реакции произойдут при контакте металлов с растворами солей или другими веществами. Также ряд напряжений позволяет определить направление электронных переносов в электрохимических процессах и использовать это знание для создания ионных батарей и других электрохимических устройств.
Все металлы с их напряжениями можно представить в виде таблицы. Для лучшего запоминания значений можно сделать выделение ключевых показателей с помощью тега strong. Также можно использовать маркированный или нумерованный список с помощью тегов ul и li.
| Металл | Напряжение, В |
|---|---|
| Литий | -3,04 |
| Калий | -2,92 |
| Цезий | -2,87 |
| Натрий | -2,71 |
| Магний | -2,37 |
| Алюминий | -1,66 |
| Цинк | -0,76 |
| Железо | -0,41 |
| Свинец | -0,13 |
| Кадмий | -0,40 |
| Водород | 0 |
| Серебро | +0,80 |
| Золото | +1,50 |
Вопрос-ответ

Какие металлы выводятся из ряда напряжения?
Из ряда напряжения выводятся только диамагнитные металлы, то есть те, которые не образуют растворы и не протекают в них окислительно-восстановительные реакции.
Какие металлы находятся в самом низу ряда напряжения?
Металлы в самом низу ряда напряжения наиболее активные, такие как литий, натрий, калий и кальций. Они способны образовывать соединения с самыми различными элементами.
Зачем нужен ряд напряжения металлов?
Ряд напряжения металлов используется для определения активности металлов и их способности образовывать ионы металла в растворе. Этот ряд помогает определить, какие металлы могут быть использованы в различных электрохимических процессах, таких как гальванические элементы и электролиз. Также данный ряд используется для предсказания протекания окислительно-восстановительных реакций.
Можно ли использовать ряд напряжения металлов для предсказания реакций в необычных условиях?
Ряд напряжения металлов предсказывает протекание реакций в стандартных условиях. Однако в необычных условиях, таких как высокие температуры или наличие специфических растворителей, порядок металлов в ряду может изменяться. Поэтому для предсказания реакций в таких условиях требуется дополнительное исследование.
