Металлы в химических реакциях обладают особыми свойствами, связанными с их электрохимической активностью. Одним из ключевых показателей активности металлов является их расположение в ряду напряжения металлов. Этот ряд упорядочивает металлы по их способности отдавать или принимать электроны в химических реакциях.
Ряд напряжения металлов включает в себя металлы различной активности, начиная с самых активных, таких как литий и калий, и заканчивая наименее активными, такими как платина и золото. Место металла в ряду напряжения определяет его способность принять участие в окислительно-восстановительных реакциях.
Кроме того, ряд напряжения металлов позволяет предсказывать результаты реакций, происходящих при контакте различных металлов с растворами ионов других металлов. В зависимости от их положения в ряду напряжения металлов, может происходить либо окисление металла, либо его восстановление. Это свойство ряда напряжения металлов находит широкое применение в различных областях, включая электрохимию, гальванизацию и производство батарей.
Роль и значение ряда напряжения металлов
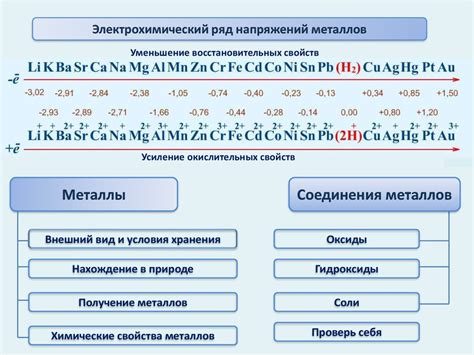
Ряд напряжения металлов – это таблица, которая отражает их способность вступать в реакции окисления и восстановления. Каждый металл в данном ряду имеет свою стандартную электродную потенциальную разность по отношению к водородному электроду при стандартных условиях.
Ряд напряжения металлов является важным инструментом для определения возможности и направления химических реакций. Он позволяет сравнивать электродные потенциалы металлов и предсказывать, будет ли металл входить в реакцию с раствором или с другим металлом. Такой анализ особенно полезен при решении задач по электрохимии и электрическим цепям.
На основе ряда напряжения металлов можно определить, какой металл является сильным окислителем или сильным восстановителем. Металлы, находящиеся выше в ряду, имеют более высокую электродную потенциальную разность и, следовательно, способны окислять металлы, находящиеся ниже их в ряду. Напротив, металлы, находящиеся ниже в ряду, могут быть окислены металлами, находящимися выше их в ряду.
Ряд напряжения металлов является основой для понимания и применения таких процессов, как гальваническая коррозия, электролиз, активация металлов и других химических реакций, связанных с электродными потенциалами металлов.
Роль и значение ряда напряжения металлов в химических реакциях

В химических реакциях ряд напряжения металлов играет важную роль и имеет значительное значение. Ряд напряжения металлов представляет собой список металлов, упорядоченных по убыванию их стандартных потенциалов окисления. Он является основой для определения возможности и направления химических реакций.
Стандартный потенциал окисления металла показывает его способность отдавать электроны и претерпевать окисление. Металлы с большими положительными значениями стандартного потенциала окисления легко отдают электроны и имеют большую склонность к окислению.
По ряду напряжения металлов можно определить, какие металлы будут претерпевать окисление, а какие будут восстанавливаться в химической реакции. Металлы, расположенные выше в ряду, будут окисляться, а металлы, расположенные ниже, будут восстанавливаться.
Значение ряда напряжения металлов позволяет предсказывать спонтанность химических реакций и определять, какие вещества будут вступать в химические реакции между собой. Эта информация важна для различных областей химии, включая электрохимию, гальванические элементы, а также процессы озонирования и электролиза.
В гальванических элементах

Роль ряда напряжения металлов в химических реакциях проявляется в гальванических элементах. Гальванический элемент представляет собой устройство, в котором происходит преобразование химической энергии в электрическую. Основой гальванического элемента являются два электрода, взаимодействующие с электролитом.
Наибольшее значение в гальваническом элементе имеет разница в потенциалах между электродами, которая определяется положением металлов в ряду напряжения. Металлы, имеющие более высокий потенциал, выступают в роли анода, а металлы с более низким потенциалом - в роли катода
В процессе работы гальванического элемента между анодом и катодом возникает разность потенциалов, которая вызывает движение электронов через внешнюю цепь. В свою очередь, электроны, переносящиеся через внешнюю цепь, вызывают химическую реакцию, протекающую в электролите.
Таким образом, ряд напряжения металлов играет ключевую роль в определении направления химической реакции и электродных потенциалов в гальванических элементах. Он обуславливает способность металлов отдавать или принимать электроны в результате окислительно-восстановительных реакций и влияет на эффективность работы гальванического элемента.
В охранной анодной защите
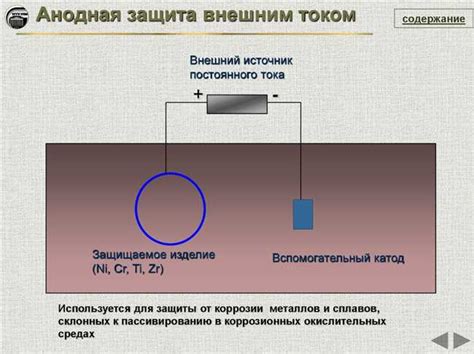
Охранная анодная защита (OAZ) – это эффективная технология защиты металлических конструкций от коррозии. Она основана на использовании ряда напряжений металлов, которые используются для защиты металла, находящегося в электролите, от электрохимической коррозии. Охранная анодная защита может быть применена в различных сферах, включая нефтегазовую промышленность, морскую отрасль и прочие области, где важно сохранить целостность и безопасность металлических объектов.
Суть охранной анодной защиты заключается в том, что на конструкцию, подлежащую защите, устанавливаются аноды, состоящие из металлов с более отрицательным потенциалом. Как правило, используются цинк или алюминий, которые обладают высокой активностью и электрохимической реакцией в контакте с электролитом, таким как вода или почва. Аноды соединяются с металлической конструкцией при помощи проводов, образуя электрический контур.
В процессе работы охранной анодной защиты происходит электрохимический процесс окисления анода. При этом аноды непотребляемы, а защищаемая конструкция становится катодом. В результате образуется стабильное электрическое поле, которое предотвращает коррозию металла катода. Охранная анодная защита позволяет значительно увеличить срок службы металлических объектов и снизить затраты на их техническое обслуживание и ремонт.
Вопрос-ответ

Зачем нужен ряд напряжения металлов?
Ряд напряжения металлов используется для определения способности металлов вступать в химические реакции, а именно, происходит оценка их окислительно-восстановительного потенциала.
Как определяется ряд напряжения металлов?
Ряд напряжения металлов определяется по их способности выступать в реакциях замещения: в ряду металлы располагаются в порядке убывания окислительно-восстановительного потенциала.
Что такое окислительно-восстановительный потенциал?
Окислительно-восстановительный потенциал - это способность вещества, в данном случае металла, принимать электроны при окислении или отдавать электроны при восстановлении.
Какие металлы находятся в верхней части ряда напряжения?
В верхней части ряда напряжения находятся активные металлы, такие как литий (Li), натрий (Na) и калий (K), которые имеют высокий окислительно-восстановительный потенциал и легко вступают в химические реакции.
Как связан ряд напряжения металлов с электрохимическими реакциями?
Ряд напряжения металлов позволяет предсказать направление электрохимической реакции: металлы, находящиеся выше в ряду, могут вытеснить металлы, находящиеся ниже в ряду из их соединений.
