Металлы являются одной из основных групп химических элементов, и они играют важную роль во многих аспектах нашей жизни. Изучение свойств и связей металлов имеет большое значение в электрохимии, сфере, изучающей взаимодействие электричества и химических процессов. Ряд напряжений металлов - это таблица, которая описывает относительные потенциалы окислительно-восстановительных реакций различных металлов.
Ряд напряжений металлов позволяет определить возможность электрохимической реакции между различными металлами. В таблице Менделеева металлы представлены в виде расположенных горизонтально рядов, где каждый ряд обозначает группу элементов схожих свойств. Вертикальные столбцы в таблице представляют различные периоды, которые характеризуют энергетические уровни элементов.
Ряд напряжений металлов основан на иерархии уровней энергии элементов и их способности образовывать ионы и протоны. Относительные потенциалы окислительно-восстановительных реакций позволяют определить, какой металл будет окисляться или восстанавливаться в химической реакции. Таким образом, таблица ряда напряжений металлов используется для прогнозирования, какие вещества будут претерпевать окисление, а какие - восстановление.
Изучение ряда напряжений металлов с таблицей Менделеева позволяет проводить анализ электрохимических реакций, предсказывать их возможность и направление, а также определить, какие вещества будут играть роль окислителей, а какие - восстановителей. Это знание имеет важное практическое значение в различных отраслях, таких как производство электроэнергии, коррозия металлов, батареи и аккумуляторы, электролиз и многое другое.
Ряд напряжений металлов

Ряд напряжений металлов – это таблица, в которой указан порядок возрастания их относительной активности в электрохимических реакциях. В этом ряду металлы располагаются по убыванию их степени окисляемости. Чем выше металл на этом ряду, тем большую склонность он имеет к окислению и более высокое его электродное напряжение.
Ряд напряжений металлов является основой для построения электрохимических рядов и определения возможности проведения электрохимических реакций. Он помогает определить, какие металлы протекают в качестве анодов, а какие в качестве катодов при проведении гальванических элементов и электролиза.
Наиболее активные металлы, такие как литий, натрий и калий, находятся в верхней части ряда напряжений. Они обладают высокой электрохимической активностью и вступают в реакции с водой и кислородом воздуха без внешнего нагрева или применения специальных условий.
Знание ряда напряжений металлов позволяет предсказывать направление электрохимических реакций и осуществлять правильный выбор материалов для различных электрохимических процессов. Кроме того, ряд напряжений металлов является важным инструментом в области коррозии металлов и защиты от нее.
Таблица Менделеева
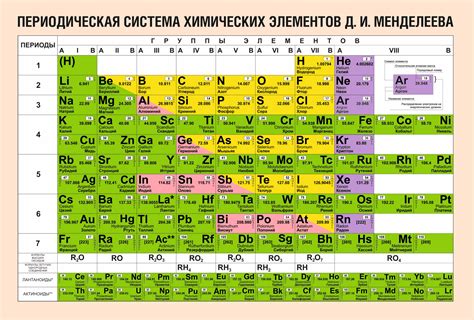
Таблица Менделеева – это основной инструмент в химическом исследовании и обучении. Она представляет собой систематическое расположение химических элементов, отражающее их свойства и связи между ними. Таблица состоит из 118 элементов, упорядоченных по возрастанию атомного числа.
Каждый элемент таблицы Менделеева представлен химическим символом, например, H для водорода, Na для натрия или Fe для железа. В таблице элементы группируются по вертикали в столбцы, называемые группами. Группы имеют общие химические свойства и количество электронов во внешней оболочке. Горизонтальные строки называются периодами и показывают количество энергетических уровней, на которых находятся электроны.
Таблица Менделеева также содержит различную информацию о каждом элементе, такую как атомная масса, атомный радиус, электроотрицательность и многое другое. Эти характеристики помогают исследователям и ученым понять свойства и взаимодействия элементов и использовать их для различных целей, включая создание новых материалов и лекарственных препаратов.
Таблица Менделеева – неотъемлемая часть химического образования и исследования. Она позволяет систематизировать информацию о химических элементах и устанавливать связи между ними, что является основой для понимания и прогнозирования химических процессов и явлений.
Электрохимия

Электрохимия - раздел физико-химической науки, изучающий перенос зарядов и превращения химической энергии в электрическую и наоборот.
Основной объект изучения в электрохимии - реакции, происходящие при переносе электронов на границе раздела двух фаз:
- окисление - процесс потери электронов;
- восстановление - процесс получение электронов.
Реакции окисления и восстановления осуществляются через электроды, на которых находится вещество, происходящее реакцию.
Для описания реакций окисления и восстановления используется понятие потенциал реакции, которое измеряется в вольтах.
Важным понятием в электрохимии является ряд напряжений металлов, который отражает их способность вступать в реакцию окисления или восстановления.
Также в электрохимии активно используется таблица Менделеева, которая позволяет организовать металлы по их электрохимической активности и потенциальной возможности вступать в реакции.
С помощью электрохимических реакций возможно получение энергии для различных целей, таких как производство электроэнергии, аккумуляторы, электролиз различных веществ и многое другое.
Ряд напряжений металлов таблица Менделеева
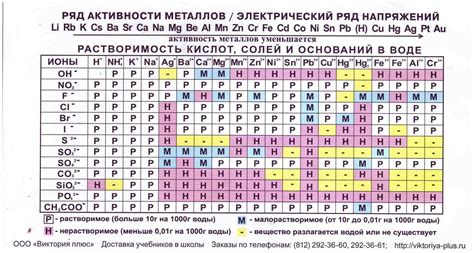
Ряд напряжений металлов - это систематическая таблица, которая отображает электрохимическую активность различных металлов во взаимодействии с растворами электролитов. Такая таблица обычно составляется на основе данных, полученных в результате экспериментов и исследований.
В основе ряда напряжений металлов лежит таблица Менделеева, которая описывает все известные химические элементы и их свойства. В ряду напряжений металлов металлы располагаются в порядке возрастания их активности. То есть, металлы, расположенные в верхней части таблицы, обладают большей электрохимической активностью в сравнении с металлами, расположенными в нижней части таблицы.
Электрохимическая активность металла является важным показателем его способности вступать в реакции окисления и восстановления. Взаимодействие металлов с растворами электролитов основано на принципе электронного переноса, где активный металл отдает электроны менее активному металлу.
Ряд напряжений металлов широко используется в электрохимии, в частности, для определения направления химической реакции при использовании различных металлов в гальванических элементах или при проведении электролиза. Знание ряда напряжений металлов позволяет предсказывать, какие металлы будут активнее реагировать с растворами и возможные химические реакции, происходящие в электрохимических системах.
Ряд напряжений металлов в химических реакциях

Ряд напряжений металлов – это упорядоченный список металлов по их способности образовывать ионные соединения с электролитами. В основе ряда лежит сравнение электрохимической активности различных металлов. Чем активнее металл химически, тем выше его степень окисления и тем больше его отрицательный потенциал в ряду напряжений.
Ряд напряжений металлов является основой для определения направления протекания электрохимических реакций. Металлы с более высокими значениями в ряду будут окисляться при контакте с металлами, имеющими более низкие значения. Такие металлы называются активными и они обладают способностью передавать электроны более пассивным металлам.
Знание ряда напряжений металлов позволяет прогнозировать, какие реакции будут протекать при взаимодействии различных металлов с растворами солей. Металлы с более высокими значениями в ряду будут вытеснять металлы с более низкими значениями, образуя ионные соединения. Этот принцип лежит в основе различных процессов, таких как гальваническая коррозия и гальванический элемент.
Таблица Менделеева часто используется для определения значений ряда напряжений металлов. В ней металлы расположены в порядке возрастания атомного номера, а значения их электрохимических потенциалов указаны рядом. Основываясь на таблице, можно составить ряд напряжений металлов и использовать его для анализа и прогнозирования химических реакций.
Важно отметить, что ряд напряжений металлов может варьироваться в зависимости от условий, в которых происходят реакции. Он может быть изменен изменением концентрации электролитов, температуры и других параметров системы. Поэтому ряд напряжений металлов следует использовать с осторожностью и учитывать особенности конкретной реакции.
Применение ряда напряжений в электрохимических процессах
Ряд напряжений металлов является важным инструментом в электрохимии, который позволяет определить потенциалы электродных полуреакций и предсказать возможность и направление химических реакций. Этот ряд, основанный на потенциалах стандартных электродных потенциалов, отражает относительную активность различных металлов и способность их участвовать в электрохимических процессах.
В электрохимических процессах ряд напряжений металлов используется для определения направления потока электронов при взаимодействии разных металлов или ионов. Металлы с более высоким потенциалом стремятся отдавать электроны, а металлы с более низким потенциалом - принимать электроны. Это свойство позволяет создавать гальванические элементы и аккумуляторы, а также применять электролиз в различных процессах.
Например, ряд напряжений металлов используется в химии для определения стандартного потенциала электродной полуреакции. В этом случае каждой полуреакции присваивается стандартный потенциал, и сравнивая это значение с потенциалами других полуреакций, можно предсказывать возможность реакций. Также ряд напряжений позволяет определить порядок металлов по их активности, что важно при выборе материалов для производства коррозионностойких металлов или в процессе гальванического покрытия.
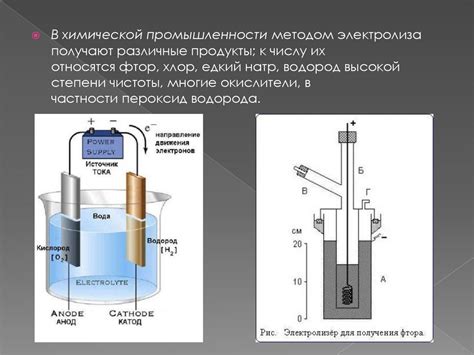
Кроме того, ряд напряжений металлов применяется в электролизе, где электрический ток приводит к процессам окисления и восстановления веществ. Процессы электролиза широко применяются в химической промышленности, например, для получения металлов из их солей, производства хлора и алюминия, а также для очистки воды. Ряд напряжений металлов позволяет предсказать, какие вещества будут окисляться или восстанавливаться при прохождении электрического тока через электролит.
В целом, ряд напряжений металлов является важным инструментом в электрохимии, который позволяет предсказывать и оптимизировать электрохимические процессы, а также применять их в различных областях промышленности и научных исследованиях.
Вопрос-ответ

Какие металлы имеют положительный потенциал окисления?
Металлы, имеющие положительный потенциал окисления, включают: калий, натрий, кальций, магний, цинк, алюминий, железо и др.
Какие металлы имеют отрицательный потенциал окисления?
Металлы, имеющие отрицательный потенциал окисления, включают: медь, серебро, золото, платину и др.
