Ряд напряжений металлов со всеми металлами является важным инструментом в химии и электрохимии. Он позволяет определить электрохимическую активность металлов и их склонность к окислительным или восстановительным реакциям. Более активные металлы имеют положительное напряжение, в то время как менее активные металлы имеют отрицательное напряжение.
Ряд напряжений металлов формируется на основе экспериментальных данных, полученных при исследовании реакций окисления и восстановления различных пар металлов. Он позволяет предсказать направление и силу реакций, которые могут происходить при контакте металлов с электролитами или другими металлами.
В ряду напряжений металлов, наиболее активные металлы располагаются в верхней части, а наименее активные - в нижней. Например, вода и пары воды взаимодействуют со всеми металлами, следовательно они находятся в верхней части ряда. Алюминий и цинк являются менее активными металлами и находятся ближе к нижней части ряда.
Влияние ряда напряжений металлов на химические свойства
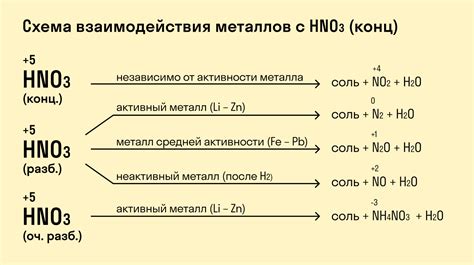
Ряд напряжений металлов – это упорядоченная таблица, в которой отражены значения потенциалов (напряжений) окисления различных металлов. Значение напряжения металлов является важным фактором, определяющим их химические свойства. Оно позволяет оценить способность металла к окислению или восстановлению в химических реакциях.
В зависимости от положения металла в ряду напряжений, его свойства могут существенно различаться. Металлы с более высокими значениями напряжений (например, литий или калий) являются сильными восстановителями, то есть способны легко отдавать электроны, образуя ионы положительного заряда.
Металлы с более низкими значениями напряжений (например, золото или платина) обладают обратным свойством – они слабые восстановители и больше склонны к окислению, то есть принимать электроны и образовывать ионы отрицательного заряда. Это обуславливает способность таких металлов сохранять свою блескость и стойкость к коррозии в агрессивных окружающих средах.
Ряд напряжений металлов позволяет определить возможность проведения электрохимических реакций между металлами. Если металл находится выше в ряду по отношению к другому металлу, то он может вытеснить его из раствора соли. Например, цинк, находящийся выше в ряду, может вытеснить медь из раствора меди(II)сульфата, так как его потенциал окисления выше.
Знание ряда напряжений металлов является важным в химической технологии и применяется в процессах гальванического покрытия, а также в электролизе и других электрохимических процессах.
Различия в ряде напряжений между металлами

Ряд напряжений металлов – это таблица с упорядоченным списком металлов по их способности вытеснить другие металлы из их растворов солей. Этот ряд является важной характеристикой металлов, так как определяет их активность в химических реакциях и их способность к коррозии.
В ряде напряжений металлы располагаются в порядке возрастания их активности. То есть, металлы, находящиеся выше в ряду, имеют большую активность и могут вытеснить из раствора солей металлы, находящиеся ниже. Например, железо (Fe) может вытеснить медь (Cu) из ее солевых растворов, так как железо находится выше меди в ряду напряжений.
Различия в ряде напряжений между металлами обусловлены их электрохимическими свойствами. Металлы, имеющие более низкий потенциал окисления, будут более активными и смогут вытеснить другие металлы из их соединений. Например, цинк (Zn) имеет более низкий потенциал окисления, чем медь, поэтому цинк может вытеснить медь из солей меди.
Различия в ряде напряжений между металлами имеют практическое значение. Они определяют, какие металлы могут быть использованы вместе без интенсивной коррозии и какие металлические соединения могут быть стабильными. Например, магний (Mg) имеет более высокий потенциал окисления, чем алюминий (Al), поэтому алюминиевые изделия не рекомендуется использовать вместе с магниевыми, чтобы избежать коррозии алюминия.
В целом, различия в ряде напряжений между металлами важны для понимания и предсказания химических реакций, а также для выбора правильных материалов в различных технических и промышленных процессах.
Значение ряда напряжений для реакций между металлами

Ряд напряжений для реакций между металлами, также известный как электрохимический ряд напряжений, является очень важным инструментом в химии и электрохимии. Он определяет относительные значения потенциалов окислительно-восстановительных реакций между различными металлами и позволяет предсказать возможность и направление таких реакций.
Значение ряда напряжений для реакций между металлами определяется по потенциалам стандартных полуячеек, в которых происходит окисление одного металла и восстановление другого. В ряду напряжений металлы располагаются в порядке убывания своих потенциалов окисления. То есть, металлы с самыми негативными значениями потенциалов окисления находятся внизу ряда, а металлы с самыми положительными значениями - вверху.
Зная значение ряда напряжений для реакций между металлами, можно определить, какой металл обладает большей способностью к окислению, а какой - к восстановлению. Если металл с более негативным потенциалом окисления находится в контакте с металлом с более положительным потенциалом, то произойдет окислительно-восстановительная реакция, при которой металл с более негативным потенциалом будет окисляться, а металл с более положительным будет восстанавливаться.
Относительные значения потенциалов, определенные в ряде напряжений для реакций между металлами, имеют большое практическое применение. Они используются для определения электродных потенциалов металлов, разработки источников электрической энергии, в технологии гальванизации и многих других областях химии и электрохимии.
Влияние ряда напряжений на проводимость металлов
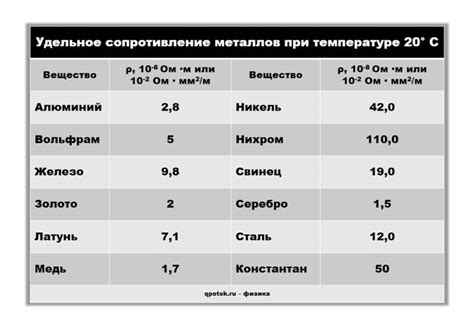
Ряд напряжений металлов – это таблица, в которой указывается электрохимическая активность металлов. Этот ряд составляется в порядке убывания электрохимической активности металлов. Ряд напряжений металлов позволяет определить возможность их окисления или восстановления в электрохимических процессах.
Влияние ряда напряжений на проводимость металлов связано с их способностью отдавать или принимать электроны. Металлы с высокой электрохимической активностью имеют большую склонность к окислению и являются хорошими восстановителями, то есть способны передавать электроны другим веществам. Напротив, металлы с низкой электрохимической активностью имеют малую склонность к окислению и обладают высокой проводимостью.
В ряду напряжений металлов находятся такие элементы, как литий, рубидий, калий и другие, которые имеют самую высокую электрохимическую активность. Они легко окисляются, поэтому металлы с высокой электрохимической активностью используются в процессах передачи электроэнергии или при производстве электротехнических устройств.
С другой стороны, металлы, которые находятся в конце ряда напряжений, такие как золото, платина, серебро, обладают низкой электрохимической активностью. Их проводимость электричества очень высокая, что делает их идеальными материалами для изготовления электрических контактов, проводников и электродов.
Практическое применение ряда напряжений металлов

Ряд напряжений металлов - это упорядоченная таблица, отражающая степень активности металлов во взаимодействии с растворами ионов. Он является важным инструментом в химической промышленности и научных исследованиях, поскольку позволяет предсказывать направление химических реакций и выбирать подходящие материалы для конкретных задач.
Одно из практических применений ряда напряжений металлов - это в гальванических элементах и аккумуляторах. Ряд напряжений позволяет выбрать два металла с разными значениями электродного потенциала и создать электрохимическую ячейку, в которой происходит преобразование химической энергии в электрическую. Благодаря ряду напряжений можно определить, какие материалы будут эффективно работать в аккумуляторах и обеспечивать высокую энергоемкость.
Ряд напряжений металлов также используется в гальваническом покрытии металлических поверхностей. Используя различные сочетания металлов из ряда напряжений, можно создавать защитные и декоративные покрытия на разных типах материалов. Например, покрытие железа цинком, используя ряд напряжений, позволяет предотвратить коррозию поверхности железа.
Другое практическое применение ряда напряжений металлов - это в процессе электролиза. Ряд напряжений позволяет определить, какие металлы легче всего осаждать на электрод при электролизе растворов ионов металлов. Это важно, например, для получения чистых металлов из руд или для осаждения покрытий на различных материалах.
Вопрос-ответ

Какие металлы входят в ряд напряжений?
В ряд напряжений входят все металлы, причем они располагаются в определенном порядке в зависимости от их химических свойств и реакционной способности. Самым реакционно способным металлом является калий, а самым реакционно неспособным металлом – золото.
Зачем нужен ряд напряжений металлов?
Ряд напряжений металлов является важным инструментом в химии и электрохимии. Он позволяет определить, какие металлы будут взаимодействовать друг с другом, образуя гальванические элементы или протекая электрохимические реакции. Кроме того, ряд напряжений металлов используется для определения степени коррозионной активности металлов.
Каков порядок металлов в ряду напряжений?
Порядок металлов в ряду напряжений определяется их реакционной способностью. На первом месте находится самый реакционно способный металл – калий, затем следуют кальций, натрий, магний, алюминий, цинк, железо, свинец, медь, ртуть, серебро и, наконец, золото – самый реакционно неподвижный металл.
Какие факторы влияют на положение металлов в ряде напряжений?
Положение металлов в ряде напряжений зависит от их электрохимических свойств и структуры кристаллической решетки. Важными факторами, влияющими на положение металлов в ряду напряжений, являются энергия ионизации, электроотрицательность элементов и их способность к образованию стабильных ионов.
