Электрохимическое напряжение металлов до водорода – это важное свойство, которое определяет их способность вступать в реакцию с водородом. Этот ряд является одной из основ электрохимии и играет важную роль в различных областях науки и промышленности.
Ряд электрохимического напряжения металлов до водорода позволяет определить, какой металл будет реагировать с водородом сильнее, а какой слабее. Он основан на принципе, при котором металлы с более отрицательным напряжением сильнее вступают в реакцию с водородом и имеют большую аффинность к этому элементу.
Знание ряда электрохимического напряжения металлов до водорода имеет практическое применение в различных областях науки и техники. Например, в производстве гальванических элементов, где выбираются металлы для анодов и катодов, а также в химическом анализе и разработке новых материалов.
В данной статье мы рассмотрим основные свойства ряда электрохимического напряжения металлов до водорода и его применение в различных областях. Мы также обсудим важность этого ряда в понимании химических реакций и определении возможных аппликаций для различных металлов.
Химическое взаимодействие металлов с водородом

Химическое взаимодействие металлов с водородом представляет собой процесс, при котором происходит образование соединений металлов с молекулами водорода. Это взаимодействие определяется рядом электрохимического напряжения металлов до водорода, который отражает их способность образовывать стабильные соединения с водородом.
Металлы могут взаимодействовать с водородом через различные реакции, такие как адсорбция, абсорбция и десорбция. Адсорбция - это процесс притягивания молекул водорода к поверхности металла и их фиксация на этой поверхности. Абсорбция - это процесс поглощения молекул водорода металлом и их проникновения в его структуру. Десорбция - это процесс высвобождения водорода из металлической структуры.
Химическое взаимодействие металлов с водородом является основой для различных аппликаций. Например, водородное сопряжение используется в процессе каталитической водородации, при которой ненасыщенные органические соединения превращаются в насыщенные в присутствии металлов в качестве катализаторов.
Кроме того, химическое взаимодействие металлов с водородом является важным аспектом в разработке и применении водородных топливных элементов, которые основаны на электрохимическом окислении водорода на аноде и редукции на катоде. Металлы с высоким электрохимическим напряжением до водорода, такие как платина или никелевые сплавы, обладают хорошей каталитической активностью для этих процессов.
Ряд электрохимического напряжения металлов до водорода

Ряд электрохимического напряжения металлов до водорода - это упорядоченный по возрастанию список металлов, начиная с самого активного, которые проявляют способность к растворению в кислотах с образованием водорода. Данный ряд является важным инструментом для прогнозирования различных химических реакций и определения возможности коррозии металлов.
В ряду электрохимического напряжения металлов до водорода наиболее активными являются щелочные металлы, такие как литий и натрий, которые легко реагируют с водой, образуя гидроксид и выделяя водородный газ. Следующими по активности в ряду идут щелочноземельные металлы, затем металлы из группы переходных элементов, а затем уже благородные металлы, такие как золото и платина.
Ряд электрохимического напряжения металлов до водорода играет важную роль в различных областях. Например, он используется в процессе гальванического покрытия металлами, где металлы с высоким электрохимическим напряжением растворяются в электролите, а их ионы осаждается на поверхности другого металла. Этот процесс позволяет создавать защитные покрытия на металлических изделиях для предотвращения коррозии и придания им декоративного вида.
Кроме того, ряд электрохимического напряжения металлов до водорода применяется в производстве водорода. Некоторые металлы, такие как алюминий и цинк, могут реагировать с кислотами, выделяя водородный газ. Этот процесс используется при производстве водорода для различных промышленных нужд, таких как производство аммиака или водородных топливных элементов.
Сравнение важных свойств металлов
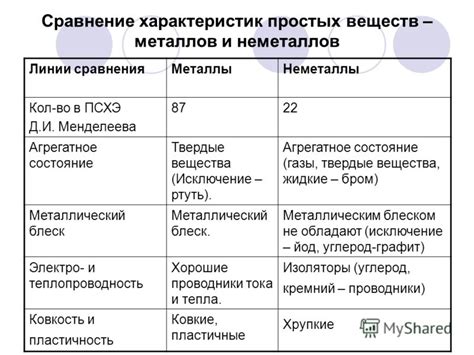
1. Водородное напряжение: Одним из важных свойств металлов является их водородное напряжение, которое определяет их способность реагировать с водородом. В зависимости от положения металла в ряду электрохимического напряжения, его водородное напряжение может быть высоким, что означает большую активность по отношению к водороду, или низким, что говорит о небольшой реакционной способности металла с водородом.
2. Химическая активность: Металлы в ряду электрохимического напряжения можно условно разделить на активные и инертные. Активные металлы обладают большой химической активностью и способностью к реакциям, как с водородом, так и с другими веществами. Инертные металлы, напротив, обычно мало реакционны и не имеют сильной химической активности.
3. Коррозионная стойкость: Металлы различаются по своей стойкости к коррозии. Некоторые металлы, такие как золото и платина, характеризуются высокой коррозионной стойкостью и способностью сохранять свои свойства при воздействии окружающей среды. Другие металлы, например, железо или алюминий, могут подвергаться различным процессам коррозии с образованием окислов и гидроксидов на их поверхности.
4. Проводимость электричества: Еще одним важным свойством металлов является их хорошая проводимость электричества. Металлы способны передавать электрический ток благодаря наличию свободных электронов в их структуре. Обладая высокой электропроводностью, металлы широко используются в различных областях, включая электротехнику и электронику.
5. Плотность: Плотность является еще одним важным свойством металлов. Она определяет массу металла, занимающего единичный объем. Металлы могут иметь разную плотность в зависимости от их состава и структуры. Это свойство влияет на их вес и позволяет использовать металлы с высокой плотностью, например, в промышленности для создания изделий с большими механическими характеристиками.
Основные аппликации металлов

Железо является одним из самых распространенных металлов, которое находит широкое применение в различных отраслях промышленности. Оно используется для изготовления строительных материалов, автомобилей, бытовой техники, а также является основным компонентом стали. Железо также применяется в электроинженерии и электронике, благодаря его хорошей электропроводности.
Алюминий имеет высокую коррозионную стойкость и легкость, поэтому широко используется в авиации, строительстве, производстве упаковочного материала и электронике. Он также применяется в производстве автомобилей, алюминиевых фольг и конденсаторов. Благодаря своим светоотражающим свойствам, алюминий также используется в изготовлении зеркал и других отражающих поверхностей.
Медь обладает высокой электропроводимостью и хорошей коррозионной стойкостью, что делает ее идеальным материалом для проводов и кабелей электрической сети. Кроме того, медь используется в производстве монет, трубопроводов, электронных компонентов и украшений. Ее антимикробные свойства также позволяют использовать медь в медицинском оборудовании и поверхностях, предотвращающих распространение бактерий.
Цинк широко применяется в гальванизации, чтобы защитить стальные изделия от коррозии. Он также используется в производстве батареек, сплавов, литейной промышленности и солнечных панелей. Цинк является важным микроэлементом для организма и используется также в фармацевтике и пищевой промышленности.
Свинец используется в производстве аккумуляторов, кабельных оболочек, рубильников и пластиковых изделий. Этот металл также применяется в медицине, где его соли используются в некоторых препаратах для лечения заболеваний, таких как пищеварительная недостаточность и отравление свинцом.
Никель широко используется в электротехнике, промышленности автомобилестроения и производстве химических веществ. Он применяется для создания нержавеющей стали, батарей, катодов и электронных компонентов. Никель также используется в ювелирном и часовом производстве, благодаря своей прочности и блеску.
Роль водорода в химической промышленности

Водород играет важную роль в химической промышленности благодаря своим уникальным химическим свойствам. Он является одним из самых распространенных элементов во Вселенной и может быть получен из различных источников, включая природный газ, воду и нефть. Водород используется в разных процессах и приложениях, что делает его одним из наиболее важных химических веществ.
Одним из основных способов использования водорода в химической промышленности является его применение в процессах синтеза различных химических соединений. Водород является чрезвычайно полезным реагентом в реакциях гидрирования, дегидрирования и метатеза, используемых для производства различных продуктов, таких как пластмассы, удобрения и фармацевтические вещества.
Кроме того, водород является важным компонентом в процессе производства аммиака, одного из основных ингредиентов удобрений. Водород используется в качестве источника энергии для катализаторов, которые требуются для синтеза аммиака из азота и водорода. Аммиак служит основой для производства ключевых химических продуктов, таких как нитрат аммония и мочевина, которые являются важными компонентами удобрений и грядущих материалов.
Кроме этого, водород также используется в процессах рафинирования нефти и производства высокочистых жидкостей. Водородные процессы позволяют удалить примеси из сырой нефти и улучшить качество конечной продукции. Водород также можно использовать для очистки и дезодорации различных продуктов и материалов.
В заключение, роль водорода в химической промышленности нельзя переоценить. Его уникальные химические свойства делают его неотъемлемой частью многих процессов и приложений. Водород является основным компонентом в синтезе химических соединений, производстве удобрений и рафинировании нефти, что делает его ценным ресурсом для промышленности.
Влияние электрохимического напряжения на электролиз
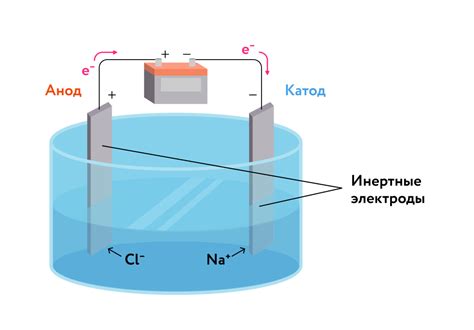
Электрохимическое напряжение металлов является важным фактором, влияющим на процесс электролиза. Относительное положение металлов в ряде напряжения определяет их электрохимическую активность и способность вступать в реакцию с веществами в электролите.
При электролизе происходит перенос электрического заряда через электролит. Положительно заряженные ионы перемещаются к отрицательному электроду (катоду), а отрицательно заряженные ионы перемещаются к положительному электроду (аноду). Электрохимическое напряжение металлов определяет, какие вещества окисляются (переходят в ионы) на аноде, а какие вещества восстанавливаются (переходят из ионов в нейтральное состояние) на катоде.
На основе электрохимического ряда металлов можно выбрать металл, который будет выполнять роль анода или катода в электролизе. Металл с более высоким электрохимическим напряжением будет окисляться на аноде, а металл с более низким напряжением будет восстанавливаться на катоде.
Важно отметить, что электрохимическое напряжение металлов также влияет на скорость электролиза и эффективность процесса. Металлы с более высоким напряжением имеют более активную электрохимическую реакцию и, следовательно, могут быть более эффективными в процессе электролиза.
Таким образом, электрохимическое напряжение металлов играет существенную роль в процессе электролиза и определяет выбор материалов для электродов, а также влияет на эффективность и скорость процесса.
Практическое применение ряда электрохимического напряжения

Ряд электрохимического напряжения металлов до водорода является важным инструментом в сфере электрохимии и материаловедения. Он определяет, какие металлы являются хорошими электродами в растворах ионов водорода, а какие - плохими. Это позволяет прогнозировать и контролировать реакции электрохимической коррозии, а также оптимизировать процессы гальванического покрытия металлов.
Электрохимическое напряжение металлов до водорода также находит применение в производстве водорода. Проводя электролиз водных растворов электролитов, можно получить водород на катоде путем редукции ионов водорода. Одновременно с этим происходит окисление анодного металла, который входит в ряд напряжения металлов до водорода. Таким образом, ряд электрохимического напряжения позволяет выбрать оптимальный материал для анода, чтобы обеспечить эффективное и стабильное производство водорода.
Кроме того, ряд электрохимического напряжения металлов до водорода используется при разработке и создании различных электрохимических устройств и батарей. Знание электрохимического потенциала металлов позволяет правильно подобрать пары материалов для создания анодов и катодов, обеспечивая эффективное преобразование энергии и повышенную стабильность работы устройства.
- Выводы:
- Ряд электрохимического напряжения металлов до водорода является важным инструментом в электрохимии и материаловедении.
- Он позволяет прогнозировать и контролировать реакции электрохимической коррозии и гальванического покрытия металлов.
- Ряд электрохимического напряжения используется в производстве водорода и создании электрохимических устройств.
Импортантность правильного выбора материалов в промышленности

В современной промышленности правильный выбор материалов является критически важным аспектом проектирования и производства различных продуктов и устройств. От выбора материалов зависит не только качество и надежность изделия, но и его эффективность, функциональность и долговечность.
В процессе проектирования и производства промышленных изделий необходимо учитывать множество факторов, таких как механические свойства материалов, их стойкость к воздействию окружающей среды, тепловые и электрические характеристики и др. Это позволяет выбрать наиболее подходящий материал для конкретной задачи и обеспечить оптимальные условия эксплуатации продукта.
Правильный выбор материалов в промышленности имеет не только техническое, но и экономическое значение. Подбирая оптимальные материалы, можно достичь снижения затрат на производство, увеличения сроков службы изделия, снижения потребления энергии и ресурсов.
Кроме того, правильный выбор материалов в промышленности имеет также и экологическое значение. Оптимизация используемых материалов позволяет уменьшить негативное влияние на окружающую среду, снизить выбросы вредных веществ и улучшить устойчивость производства к изменениям климата.
В целом, импортантность правильного выбора материалов в промышленности не может быть переоценена. Это непременное условие для достижения высокого качества, эффективности и конкурентоспособности продукции, а также сокращения негативного влияния на окружающую среду и рационального использования ресурсов.
Вопрос-ответ

Какие металлы обладают большим электрохимическим напряжением?
Металлы, обладающие большим электрохимическим напряжением, включают литий, цезий, калий и другие щелочные металлы.
Каково значение электрохимического напряжения металлов до водорода?
Значение электрохимического напряжения металлов до водорода различается для разных металлов. Наиболее часто используется значение напряжения для стандартных условий (25 °C, один разбавленный моль вещества) и выражается в вольтах.
Как можно использовать ряд электрохимического напряжения металлов?
Ряд электрохимического напряжения металлов может быть использован для предсказания химических реакций, происходящих в электрохимических элементах и батареях. Он также помогает определить, какой металл выступит в роли анода, а какой в роли катода.
Какой металл обладает самым большим электрохимическим напряжением до водорода?
Литий обладает самым большим электрохимическим напряжением до водорода среди всех металлов. Это свойство делает литий одним из самых популярных материалов для использования в литий-ионных аккумуляторах.
Каким образом ряд электрохимического напряжения металлов может быть применен в промышленности?
Ряд электрохимического напряжения металлов может быть применен в промышленности для электрохимической обработки поверхностей металлических изделий, электроосаждения металлов, а также в процессах гальванопластики и гальванизации.
