В химии ряд электроотрицательности металлов играет важную роль при изучении взаимодействия различных веществ. Электроотрицательность представляет собой меру способности атома притягивать к себе электроны во время химических реакций. Чем выше электроотрицательность, тем сильнее атом притягивает электроны. Этот параметр представляет собой важный фактор, определяющий реактивность металлов и их способность образовывать химические связи.
Благодаря ряду электроотрицательности металлов можно предсказывать, какой элемент будет вытеснять другой из своих химических соединений. По такому ряду можно определить, какие химические реакции протекут с выделением энергии и какие – с поглощением. Например, электроотрицательность металла может помочь предсказать, будет ли он реагировать с кислородом и образовывать оксид.
Ряд электроотрицательности металлов позволяет также объяснить структуру веществ и их свойства. Силы взаимодействия между атомами определяют вид кристаллической решетки, температуру точки кипения и плавления, электрическую проводимость и другие характеристики. Таким образом, ряд электроотрицательности металлов является ключом к пониманию взаимодействия веществ и может быть использован для разработки новых материалов с определенными свойствами.
Ряд электроотрицательности металлов: ключ к пониманию взаимодействия веществ

Ряд электроотрицательности металлов представляет собой упорядоченный список элементов, отсортированных по их способности притягивать электроны в химических реакциях. Этот ряд является важным инструментом в химии, помогающим понять и предсказать взаимодействие различных веществ.
На вершине ряда находятся самые электроотрицательные металлы, такие как фтор, кислород и хлор. Они обладают большой силой притяжения электронов и часто вступают в реакции с другими веществами, отдавая электроны и образуя положительные ионы.
Снизу ряда находятся металлы с меньшей электроотрицательностью. Они обладают меньшей способностью притягивать электроны и часто вступают в реакции, получая электроны от других веществ. Эти металлы часто образуют положительно заряженные ионы.
Использование ряда электроотрицательности металлов позволяет понять, какие вещества могут взаимодействовать между собой. Если элемент расположен выше в ряду, то он может заместить элементы, расположенные ниже, в химических реакциях. Если элементы находятся на одной горизонтали в ряду, то они могут образовывать стабильные химические соединения.
Важно отметить, что ряд электроотрицательности металлов является лишь одним из многих инструментов в химии и не учитывает другие факторы, такие как размер и заряд ядра. Однако, он является полезным средством для предсказания химических реакций и изучения взаимодействия веществ.
Значение ряда электроотрицательности
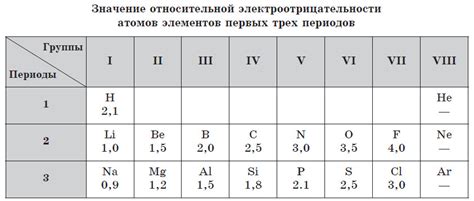
Ряд электроотрицательности — это список, который показывает относительную способность атомов притягивать электроны в химической связи. Чем выше значение в ряду, тем сильнее атом притягивает электроны. Значение ряда электроотрицательности является ключевым моментом в понимании взаимодействия веществ и определяет химические свойства элементов.
Ряд электроотрицательности позволяет определить, какие атомы в молекуле обладают положительным или отрицательным зарядом, что в свою очередь влияет на химические реакции и связи между атомами. Более электроотрицательный элемент имеет большую тенденцию к получению электронов и образованию отрицательного заряда, в то время как менее электроотрицательный элемент склонен отдавать электроны и образованию положительного заряда.
Значение ряда электроотрицательности также помогает в определении типа химической связи. В случае, если разница в электроотрицательности между атомами минимальна, образуется неметаллическая ковалентная связь. Если разница в электроотрицательности большая, то образуется ионная связь, где один атом отдаёт электроны другому. Это значительно влияет на физические и химические свойства вещества.
Значение ряда электроотрицательности можно использовать для предсказания и разъяснения реакций, образования соединений и свойств веществ. Оно также помогает понять, почему некоторые вещества взаимодействуют более активно, в то время как другие остаются стабильными и инертными.
Взаимодействие металлов и неметаллов

Металлы и неметаллы являются двумя основными группами химических элементов, имеющими различные свойства и взаимодействие друг с другом. Данные взаимодействия основаны на соотношении электроотрицательностей металлов и неметаллов.
Металлы, как правило, имеют низкую электроотрицательность, что позволяет им легко отдавать электроны. Неметаллы, в свою очередь, имеют высокую электроотрицательность и обладают способностью принимать электроны. В результате этих различий, возникают разнообразные химические реакции между металлами и неметаллами.
Основные виды взаимодействий включают образование ионов и ионных связей, образование ковалентных соединений и межмолекулярные силы. В ионных связях металл отдает электрон(-ы) неметаллу, образуя положительно заряженные ионы металла и отрицательно заряженные ионы неметалла.
Ковалентная связь происходит, когда электроны между атомами металлов и неметаллов делают общие оболочки. В результате образуется молекула, которая может быть заряжена или незаряжена. Кроме того, металлы и неметаллы могут взаимодействовать межмолекулярными силами, такими как ван-дер-ваальсовы силы и диполь-дипольные взаимодействия.
Такое взаимодействие между металлами и неметаллами является основой для образования различных химических соединений, таких как соли, кислоты, основания и многое другое. Изучение этого взаимодействия позволяет лучше понять природу химических реакций и свойства различных веществ.
Применение ряда электроотрицательности

Ряд электроотрицательности металлов является основным инструментом для понимания химической реактивности и взаимодействия различных веществ. Это упорядоченный список элементов, отражающий их склонность к принятию или отдаче электронов в химических реакциях.
Применение ряда электроотрицательности может быть полезным во многих аспектах химии и материаловедения. Например, при вычислении электродного потенциала металлов, ряд электроотрицательности помогает определить, какие металлы будут вести себя как аноды (отдавать электроны) и какие будут вести себя как катоды (принимать электроны) в электролитических процессах.
Кроме того, ряд электроотрицательности позволяет предсказать, какие элементы будут образовывать ионы с положительным или отрицательным зарядом при реакциях с неэлектролитами. Это особенно важно при составлении химических уравнений и анализе химических реакций.
Применение ряда электроотрицательности также находит свое применение в органической химии, где ряд электроотрицательности помогает предсказать, какие атомы будут образовывать связи с положительным или отрицательным зарядом при образовании органических соединений.
Вопрос-ответ

Как определяется электроотрицательность металлов?
Электроотрицательность металлов определяется их способностью притягивать электроны при химической связи. Чем выше электроотрицательность металла, тем сильнее он притягивает электроны и тем активнее может взаимодействовать с другими веществами.
Как взаимодействие металлов с другими веществами зависит от их электроотрицательности?
Взаимодействие металлов с другими веществами зависит от разности электроотрицательностей. Если разность электроотрицательностей металла и вещества, с которым он взаимодействует, большая, то металл может передавать электроны и образовывать ионные связи. Если разность электроотрицательностей маленькая, то металл может образовывать металлические связи, где электроны свободно передвигаются между атомами металла.
Какое значение имеет ряд электроотрицательности металлов?
Ряд электроотрицательности металлов является ключевым инструментом в химии, поскольку он позволяет предсказывать химические свойства и взаимодействия металлов с другими веществами. Благодаря ряду электроотрицательности можно определить, какой металл активнее будет взаимодействовать с данной веществом и какие виды связей будут образовываться.
