Электроотрицательность металлов является одной из ключевых характеристик химических элементов, определяющих их химические свойства и способность образовывать соединения. Ряд электроотрицательности металлов показывает, насколько сильно атом металла притягивает электроны при образовании соединений с атомами других элементов. Чем выше значение электроотрицательности металла, тем сильнее он притягивает электроны.
Сравнение электроотрицательности нескольких важных металлов позволяет лучше понять их химические свойства и влияние на реакции и соединения. Наиболее электроотрицательными металлами являются фтор, азот, кислород и хлор, которые имеют наибольшую способность к притяжению электронов. Среди металлов наиболее электроотрицательными являются алюминий, магний и калий.
Понимание ряда электроотрицательности металлов имеет важное значение в химических реакциях и образовании химических соединений. Это помогает определить возможность реакций между металлами и неметаллами, а также понять, какие соединения могут быть образованы на основе определенных металлов. Исследование электроотрицательности металлов также полезно в разработке новых материалов и сплавов с определенными свойствами.
Ряд электроотрицательности металлов
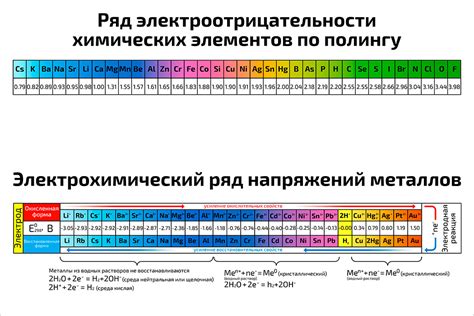
Ряд электроотрицательности металлов представляет собой упорядоченный список металлических элементов по возрастанию их способности привлекать электроны при образовании химических связей. Он является важным инструментом для изучения реакций и взаимодействий различных металлов в химических системах.
На вершине ряда электроотрицательности находятся самые электроотрицательные металлы, такие как фтор и хлор. Они обладают высокой способностью привлекать электроны, что делает их сильными окислителями. С другой стороны, на самом низу ряда находятся металлы с низкой электроотрицательностью, такие как калий и натрий. Они обладают низкой способностью привлекать электроны и являются хорошими восстановителями.
Ряд электроотрицательности помогает предсказывать результаты реакций между различными металлами. Металлы с более высокой электроотрицательностью будут реагировать с металлами с более низкой электроотрицательностью, образуя ионные соединения. Например, натрий и хлор реагируют, образуя поваренную соль - ионное соединение, в котором натрий отдает электроны хлору.
Также, ряд электроотрицательности используется для предсказания окислительных свойств металлов. Металлы с более высокой электроотрицательностью имеют большую способность окислять другие металлы, тогда как металлы с низкой электроотрицательностью имеют большую способность восстанавливать оксиды других металлов.
Ряд электроотрицательности металлов является важным инструментом для понимания и предсказания химических свойств различных металлов. Он позволяет определить, какие металлы могут быть использованы для конкретных химических реакций, а также предсказать их взаимодействия в различных химических системах.
Сравнение важных элементов
Элементы в таблице периодических элементов имеют различные свойства, которые делают их полезными и важными в различных областях науки и промышленности. Важные элементы - это те, которые имеют широкое применение и значительное влияние на нашу жизнь.
Один из важных элементов - кислород. Он является неотъемлемым компонентом воздуха и необходим для дыхания организмов. Кислород также широко используется в процессе сжигания и окисления, как в промышленности, так и в быту. Он играет важную роль в процессах горения, дыхания, окисления и окружающей среде.
Другим важным элементом является железо. Оно является одним из наиболее распространенных металлов на Земле и имеет широкое применение в промышленности и конструкции. Железо используется для производства стали, которая является основным материалом для постройки зданий, мостов и транспортных средств. Также железо входит в состав гемоглобина - важного компонента крови, который обеспечивает перенос кислорода в организме.
Алюминий является еще одним важным элементом. Он имеет низкую плотность, высокую прочность и хорошую коррозионную стойкость, что делает его идеальным материалом для производства самолетов, автомобилей и других транспортных средств. Алюминий также широко используется в производстве упаковочных материалов, электроники и конструкций.
Благодаря своим уникальным свойствам, эти важные элементы играют важную роль в различных сферах нашей жизни. Они не только обеспечивают нам необходимые материалы и ресурсы, но и влияют на наше здоровье и окружающую среду.
Влияние электроотрицательности на химические свойства

Электроотрицательность химического элемента является одним из важных факторов, определяющих его поведение в химических реакциях. Электроотрицательность характеризует способность атома притягивать к себе электроны в химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны и тем более полярной будет химическая связь.
Электроотрицательность влияет на различные химические свойства элементов, включая их реакционную активность, способность образовывать соединения и химические связи. Элементы с высокой электроотрицательностью, такие как кислород, хлор и фтор, обладают большой способностью образовывать ионы и притягивать электроны, что делает их сильными окислителями.
В то же время, элементы с низкой электроотрицательностью, такие как алюминий, натрий и железо, имеют меньшую способность притягивать электроны и склонны образовывать положительно заряженные ионы. Этот факт определяет их свойства в качестве восстановителей в различных химических реакциях.
Электроотрицательность также влияет на положение элементов в периодической таблице. Вертикальные группы элементов схожей электроотрицательностью обладают схожими химическими свойствами. Горизонтальные периоды, наоборот, характеризуются изменением электроотрицательности, что влияет на тип и силу химической связи, образуемой элементом.
Таким образом, электроотрицательность играет важную роль в определении химических свойств элементов и их поведения в химических реакциях. Понимание этого понятия помогает объяснить различные химические явления и предсказывать поведение элементов в различных условиях.
Классификация элементов в ряду электроотрицательности
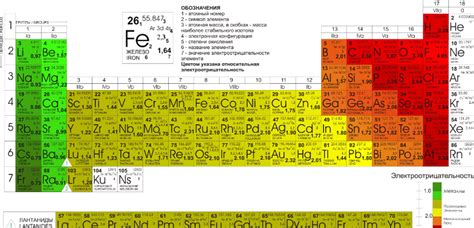
Ряд электроотрицательности металлов представляет собой упорядоченный список элементов, отсортированных по возрастанию их электроотрицательности. Электроотрицательность – это способность атома притягивать к себе электроны в химической связи.
В ряду электроотрицательности элементы классифицируются в зависимости от своей способности притягивать электроны. Наиболее электроотрицательные элементы находятся в верхней части ряда, а наименее электроотрицательные – в нижней. Вершина ряда занимается флуор, который считается самым электроотрицательным элементом. Наименее электроотрицательным элементом является цезий.
Классификация элементов в ряду электроотрицательности позволяет оценить и предсказать химические свойства и реакционную способность элементов. Чем выше электроотрицательность элемента, тем больше вероятность, что он будет образовывать ион с положительным зарядом, тогда как элемент с низкой электроотрицательностью будет образовывать ион с отрицательным зарядом.
Применение ряда электроотрицательности в химии
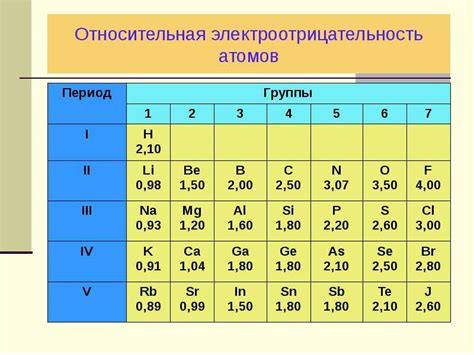
Ряд электроотрицательности металлов является важным инструментом для понимания и предсказания химических реакций и свойств веществ. Электроотрицательность — это характеристика атома, которая описывает его способность притягивать электроны к себе в химической связи.
В химии ряд электроотрицательности используется для определения характера и направления химических реакций. Реакции между элементами, имеющими большую разницу в электроотрицательности, обычно являются ионно-кавалентными, где электроны передаются от одного атома к другому. Наоборот, связь между элементами с малой разницей в электроотрицательности может быть совместной, ковалентной.
Ряд электроотрицательности также позволяет определить, какие элементы могут вытеснить другие из их соединений при проведении химических реакций. Элемент с большей электроотрицательностью может вытеснить элемент с более низкой электроотрицательностью из связи с другим элементом.
Кроме того, ряд электроотрицательности помогает определить полюсность молекулы. Если атомы в молекуле различаются по электроотрицательности, то возникают полярные связи и полярные молекулы. Это имеет большое значение в изучении химических свойств соединений и их использовании в различных областях науки и технологий.
Вопрос-ответ

Что такое электроотрицательность металлов и зачем она нужна?
Электроотрицательность металлов — это их способность притягивать электроны во время химических реакций. Она играет важную роль в формировании химических связей, определяя, насколько хорошо металл способен отдавать или получать электроны. Эта характеристика помогает в классификации металлов и предсказании их химических свойств.
Как можно узнать электроотрицательность металлов?
Электроотрицательность металлов можно найти в таблице довольно точных значений, называемой "рядом электроотрицательности металлов". В этой таблице элементы упорядочены по убыванию электроотрицательности. Наиболее электроотрицательные элементы находятся в верхней части таблицы, а наименее электроотрицательные — внизу.
Какие элементы являются самыми электроотрицательными?
Самыми электроотрицательными элементами в ряду металлов являются кислород, фтор и хлор. Они притягивают электроны очень сильно и, следовательно, имеют высокую электроотрицательность. Этими элементами можно описать свойства многих соединений и химических реакций.
