Металлы являются одной из основных групп химических элементов, обладающих множеством уникальных свойств. Одной из характеристик металлов является их активность, которая определяется способностью металлов образовывать ион положительного заряда и легко взаимодействовать с другими веществами.
Ряд более активных металлов включает такие элементы, как калий (K), натрий (Na), литий (Li), рубидий (Rb) и цезий (Cs). Они относятся к щелочным металлам и обладают высокой активностью. Эти металлы легко окисляются воздухом и реагируют с водой, образуя гидроксиды и высвобождая водород. Кроме того, они обладают низкой плотностью и низкой температурой плавления.
Свойства этих металлов часто используются в различных сферах жизни. Натрий, например, применяется в производстве щелочей, стекла и мыла. Калий используется в производстве удобрений и в процессах кализации почвы. Литий широко применяется в производстве аккумуляторов и лекарственных препаратов. Таким образом, ряд более активных металлов является важным компонентом многих производственных процессов и имеет широкий спектр применения.
Свойства активных металлов

Активные металлы – это элементы, обладающие высокой степенью электроотрицательности и способностью образовывать ионы с положительным зарядом. Они имеют низкую энергию ионизации, что позволяет им легко отдавать электроны и образовывать ионы. В результате активные металлы проявляют различные свойства, которые делают их полезными в различных областях.
Одной из важных особенностей активных металлов является их высокая реактивность. Они способны активно вступать в химические реакции, особенно с кислородом и водой. Например, щелочные металлы, такие как натрий и калий, реагируют с водой, образуя щелочные гидроксиды и выделяя водород. Эта реакция очень сильно выделяет тепло и может быть использована для получения энергии.
Еще одним важным свойством активных металлов является их способность образовывать сплавы с другими металлами. Например, алюминий, который является одним из самых активных металлов, легируется с другими элементами, чтобы улучшить его механические свойства. Также активные металлы могут использоваться в процессе гальванического покрытия, где они покрывают защитным слоем другие металлы, чтобы предотвратить их коррозию.
Важно отметить, что активные металлы имеют низкую плотность, что делает их легкими и удобными для использования в промышленности. Например, литий обладает самой низкой плотностью из всех металлов и находит применение в производстве легких батарей и аккумуляторов. Алюминий также является легким металлом и применяется в авиационной и автомобильной промышленности из-за своей низкой массы и высокой прочности.
Реакция с водой

Активные металлы обладают способностью реагировать с водой, образуя оксиды металлов и выделяя водород. Реакция с водой может иметь различную интенсивность в зависимости от свойств металла.
Самым активным металлом, реагирующим с водой, является калий. При контакте с водой калий интенсивно горит, выделяется водород и образуется гидроксид калия.
Натрий также активно реагирует с водой, но его реакция проходит более спокойно, чем у калия. При взаимодействии натрия с водой образуется гидроксид натрия и выделяется водород.
Литий, в отличие от калия и натрия, реагирует с водой достаточно медленно и спокойно. При этом образуется гидроксид лития и выделяется водород.
Остальные щелочные металлы, такие как рубидий и цезий, также реагируют с водой, но их реакция происходит еще медленнее, чем у лития.
Кислотность раствора

Кислотность раствора характеризует его способность отдавать протоны и образовывать ионы водорода. Кислотность связана с концентрацией и активностью водородных ионов в растворе. Для измерения кислотности используют понятие pH.
У металлов с высокой активностью, таких как натрий (Na) и калий (K), растворы обладают высокой щелочностью. В растворах натрия и калия pH может быть выше 7. Это связано с их способностью активно реагировать с водой и образовывать гидроксидные ионы.
Наоборот, металлы с низкой активностью, такие как железо (Fe) и медь (Cu), образуют растворы с низкой кислотностью. В их растворах pH может быть ниже 7. Это связано с их слабой реакцией с водой и низкой способностью отдавать протоны.
Кроме металлов, кислотность раствора может быть обусловлена также различными реакциями, происходящими с участием органических соединений или других неорганических веществ. Например, карбоновые кислоты могут образовывать растворы с низким pH, а аминокислоты - среднюю кислотность.
Окислительные свойства
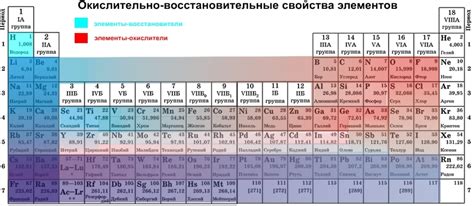
Окислительные свойства металлов - это их способность вступать в химические реакции с другими веществами, передавая электроны. Более активные металлы обладают большей склонностью к окислению, чем менее активные металлы.
Активные металлы, такие как натрий, калий и кальций, легко окисляются при контакте со воздухом, образуя оксиды металла. Например, натрий при реакции с кислородом образует оксид натрия (Na2O), а калий - оксид калия (K2O).
Вода также является сильным окислителем для некоторых металлов. Например, натрий реагирует с водой, образуя гидроксид натрия (NaOH) и выделяя водород. Кальций и магний также реагируют с водой, но медленнее.
Более активные металлы могут реагировать с кислотами, образуя соли и выделяя водород. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка (ZnCl2) и выделяя водородный газ. Алюминий также реагирует с кислотами, но более медленно.
Ряд более активных металлов может быть использован для восстановления менее активных металлов из их солей. Например, медь может быть восстановлена из солей ртутного соединения с помощью цинка. При этом цинк окисляется, а медь восстанавливается.
Окислительные свойства металлов играют важную роль в различных химических процессах и в промышленности. Они также могут быть использованы в различных химических реакциях и в лаборатории.
Специфические свойства некоторых активных металлов

Цинк является активным металлом с относительно низкой плотностью и хорошей коррозионной устойчивостью. Он обладает высокой электроотрицательностью и служит основой для сформирования защитной оксидной пленки на своей поверхности, что позволяет предотвращать дальнейшую коррозию. Цинк также обладает антибактериальными свойствами и широко используется в медицине и косметической промышленности.
Магний является легким металлом с высокой ударной прочностью. Он также обладает высокой электропроводностью и теплопроводностью, что делает его идеальным материалом для использования в авиации и автомобилестроении. Магний также хорошо реагирует с кислородом, что делает его прекрасным компонентом в производстве взрывчатых веществ.
Алюминий является легким металлом с высокой прочностью и отличными коррозионными свойствами. С поверхности алюминия формируется пассивная оксидная пленка, которая предотвращает дальнейшую коррозию. Благодаря своим свойствам, алюминий широко используется в авиационной и строительной отраслях, а также в производстве упаковки и спортивных товаров.
Натрий является металлом с высокой электропроводностью, что делает его идеальным материалом для использования в электротехнике и производстве батарей. Натрий также обладает высокой реактивностью с водой, что приводит к выделению водорода и образованию щелочи. Из-за этого натрий хранится в специальных невоздухонепроницаемых упаковках, чтобы предотвратить его взаимодействие с влагой.
Литий

Литий - химический элемент с атомным номером 3 и атомной массой около 6.94. Он относится к группе щелочных металлов в периодической таблице элементов. Литий является наименьшим и самым легким металлом, обладающим высокой активностью.
Этот металл имеет серебристо-белый цвет и отличается от других металлов своей низкой плотностью. Литий также обладает низким точкой плавления и кипения, что делает его полезным в различных промышленных процессах.
Одним из наиболее важных свойств лития является его высокая реактивность. Этот элемент легко взаимодействует с водой, образуя гидроксид лития и высвобождая водородный газ. Кроме того, литий также может реагировать с кислородом, образуя оксид лития, который хорошо растворим в воде.
Литий используется в различных областях, включая производство легких сплавов для авиации и оборонной промышленности. Он также находит применение в производстве аккумуляторов, так как литиевые ионные аккумуляторные батареи обладают высокой энергетической плотностью и долгим сроком службы.
Калий

Калий – это химический элемент из группы щелочных металлов. Его атомный номер равен 19, а атомная масса 39,1. Калий относится к благородной металлической группе и является бесцветным и мягким элементом.
Основной источник калия – это его минеральные соли, такие как силикаты и хлориды. Калий является важным питательным элементом для растений и животных. Он необходим для поддержания электролитного баланса в организме, участвует в передаче нервных импульсов и много других биологических процессах.
Физические свойства калия включают низкую плотность (0,86 г/см³), низкую температуру плавления (-63 °C) и кипения (774 °C), а также хорошую электропроводность. Калий реагирует с водой с выделением водорода и образованием щелочной среды. Он также может гореть на воздухе, что делает его опасным для обработки.
Калий находит применение в различных отраслях. Он используется в производстве удобрений, стекла, мыла и других химических соединений. Калий также используется в батареях и других электрохимических устройствах, благодаря своим электрохимическим свойствам.
Вопрос-ответ

Какие металлы относятся к более активным?
К более активным металлам относятся, например, литий, натрий, калий, цезий и рубидий.
Какими свойствами обладают более активные металлы?
Более активные металлы обладают такими свойствами, как высокая реакционная способность, высокая электропроводность, низкая температура плавления и кипения.
В каких отраслях применяются более активные металлы?
Более активные металлы широко применяются в отраслях, таких как производство батарей, производство шасси для электронных устройств, производство огнетушителей и многое другое.
