Взаимодействие металлов с кислородом является одной из важных тем в химии и материаловедении. Исследования в этой области позволяют понять процессы окисления металлов, их влияние на окружающую среду и разработать новые материалы с улучшенными свойствами.
Одним из распространенных методов изучения взаимодействия металлов с кислородом является экспериментальный подход. В ходе экспериментов исследователи изучают, как изменяются свойства металлов при воздействии на них кислорода. Они измеряют скорость окисления, температуру плавления и другие характеристики, чтобы определить, как металлы взаимодействуют с кислородом и как эти процессы могут быть контролируемыми.
Результаты экспериментов по взаимодействию металлов с кислородом находят свое применение в различных областях, включая строительство, энергетику и медицину. Полученные данные помогают улучшить свойства материалов, используемых в строительстве, таких как прочность и стойкость к коррозии. В энергетике, исследования металлов и кислорода позволяют разрабатывать новые материалы для эффективных батарей и солнечных батарей. В медицине, изучение взаимодействия металлов с кислородом помогает разрабатывать новые материалы для имплантантов и протезов, которые могут улучшить жизнь многих людей.
В итоге, изучение взаимодействия металлов с кислородом является актуальной и интересной областью научных исследований. Этис опыты и применение результатов позволяют разрабатывать новые материалы с повышенными свойствами и применять их в различных сферах жизни. Этот направление химии и материаловедения продолжит развиваться и принести еще больше полезных материалов и технологий в будущем.
Изучение реакций металлов с кислородом в лаборатории
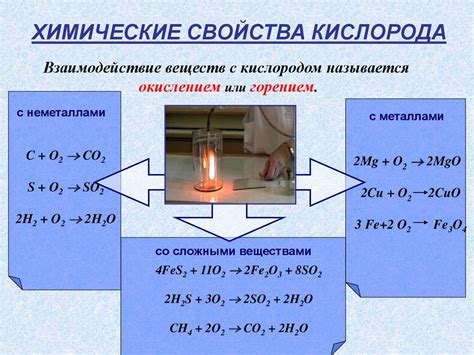
Одной из важных задач химической науки является изучение реакций металлов с кислородом. Эти реакции имеют большое практическое значение и широко применяются в различных областях, таких как металлургия, электротехника, растворительная химия и другие.
Для проведения экспериментов по изучению реакций металлов с кислородом используются специально оборудованные лаборатории. В них создаются условия, при которых возможно взаимодействие металлов с кислородом, а также наблюдение и анализ полученных результатов.
В процессе экспериментов металлы подвергаются воздействию кислорода при различных температурах и давлениях. Изучаются скорость реакции, образование оксидов и других веществ, а также их свойства и характеристики.
Для более точного контроля и измерения результатов экспериментов применяются различные методы и приборы. Например, для измерения температуры используют термометры, для определения состава веществ – спектральные методы анализа.
Результаты экспериментов по изучению реакций металлов с кислородом позволяют расширить наши знания о физико-химических свойствах металлов и использовать их в практических целях. На основе этих данных можно разрабатывать новые материалы и технологии, улучшать существующие процессы и создавать новые разработки.
Кинетика окисления металлов в присутствии кислорода
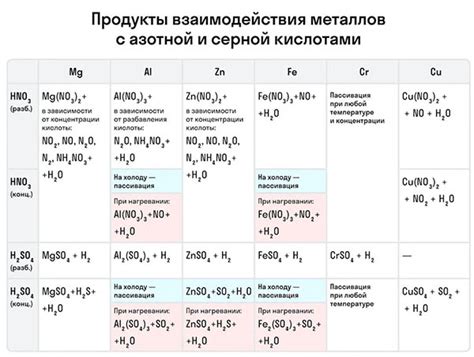
Окисление металлов в присутствии кислорода - это процесс, в ходе которого металлы вступают в реакцию с кислородом, образуя оксиды, ионно-молекулярные соединения между металлом и кислородом.
Кинетика окисления металлов может быть описана через скорость реакции. Эта скорость зависит от множества факторов, включая концентрацию кислорода, температуру, поверхность металла и наличие катализаторов.
Повышение концентрации кислорода увеличивает скорость окисления металлов, так как больше кислорода может вступить в реакцию с металлом. При повышении температуры скорость окисления также увеличивается, так как повышение температуры способствует активации молекулярных движений и ускоряет процесс реакции.
Поверхность металла играет важную роль в кинетике окисления. Чем больше поверхность металла, тем больше места есть для вступления в реакцию с кислородом, следовательно скорость реакции будет выше. Наличие катализаторов может ускорять процесс окисления, действуя как промежуточное соединение и увеличивая реакционную активность металла.
Изучение кинетики окисления металлов в присутствии кислорода имеет огромное практическое значение. Эти процессы широко применяются в различных областях, включая промышленность, энергетику, производство материалов и катализаторов. Понимание и контроль кинетики окисления металлов позволяет повысить эффективность процессов и избежать нежелательных побочных реакций.
Влияние металлических примесей на окислительную активность кислорода
Металлы обладают особой способностью взаимодействовать с кислородом и проявлять окислительную активность. Однако, добавление различных металлических примесей может в значительной степени изменить эту активность и эффективность окисления.
Например, некоторые металлы, такие как железо и медь, могут ускорять окисление органических соединений, таких как алкены и спирты. Это связано с тем, что эти металлы могут образовывать активные кислородные центры, способные проводить перенос электрона и активировать кислородные молекулы.
С другой стороны, некоторые металлы, например, платина и золото, обратно снижают окислительную активность кислорода. Это может быть объяснено их высокой адсорбцией кислорода на поверхности и образованием инертных оксидов, которые не могут дальше участвовать в окислительных реакциях.
Металлические примеси также могут значительно влиять на каталитическую активность и долговечность кислородных электродов, используемых в электрохимических процессах, таких как электролиз и гальваническое покрытие. Например, добавление небольшого количества металлов, таких как рутений или иридий, может увеличить эффективность электрокаталитических реакций и снизить энергозатраты.
Таким образом, взаимодействие металлов с кислородом является многогранным процессом, который зависит от множества факторов, включая вид и количество металлических примесей. Изучение этого взаимодействия имеет большое значение как для фундаментальных исследований, так и для разработки новых технологий и материалов с улучшенными окислительными свойствами.
Применение реактивности металлов и кислорода в промышленности

Металлы и кислород широко применяются в различных отраслях промышленности благодаря своей высокой реактивности и химическим свойствам.
Один из основных способов использования реактивности металлов и кислорода - это применение при производстве стали. Кислород служит для окисления примесей в железе и других металлах, что позволяет получить более чистую сталь с нужными характеристиками. Этот процесс, называемый кислородной конверсией, является одним из ключевых шагов в производстве стали.
Кроме того, реактивность металлов и кислорода используется при производстве сплавов, таких как алюминий, медь и титан. В этих процессах кислород служит для окисления примесей и удаления нежелательных элементов, что позволяет получить сплавы с нужными свойствами, такие как прочность и устойчивость к коррозии.
В других областях промышленности реактивность металлов и кислорода также находит широкое применение. Например, в процессе выработки энергии кислород используется для сжигания топлива, обеспечивая высокие температуры и увеличивая эффективность работы энергетических установок.
Использование реактивности металлов и кислорода в промышленности имеет большое значение для производственных процессов, позволяя получать материалы с нужными характеристиками и повышая эффективность различных технологий. Благодаря этому, отрасли промышленности могут выпускать качественные продукты и увеличивать свою производительность.
Роль окислительно-восстановительных реакций в электрохимии

Окислительно-восстановительные реакции играют важную роль в электрохимии, которая изучает электрические явления, связанные с переносом заряда в химических процессах. В этих реакциях происходит обмен электронами между веществами, что позволяет создавать электрический ток и использовать его в различных промышленных и технических процессах.
Окислитель - вещество, способное принять электрон, а восстановитель - вещество, способное отдать электрон. Эти процессы происходят одновременно и образуют окислительно-восстановительную реакцию. В электролизе, например, при подаче электрического тока на электроды, на одном из них происходит окисление (потеря электрона), а на другом - восстановление (приобретение электрона).
Такие реакции широко используются в различных областях науки и техники. Например, в электрохимических аккумуляторах происходят окислительно-восстановительные реакции, которые позволяют хранить и выделять электрическую энергию. Также эти реакции используются при производстве металлов и сплавов, очистке воды, синтезе органических соединений и в других индустриальных процессах.
Окислительно-восстановительные реакции имеют много применений в нашей жизни. Например, в химических анализах они используются для определения концентрации веществ, расчета электрохимической стабильности материалов и многих других задач. Кроме того, эти реакции имеют важное значение в медицине, где используются для определения уровня глюкозы в крови, обнаружения различных маркеров заболеваний и других исследований.
Использование оксидов металлов в катализаторах

Оксиды металлов являются важными компонентами катализаторов и находят широкое применение в различных промышленных процессах. Благодаря своей специфической структуре и химическим свойствам, оксиды металлов обладают высокой активностью и способностью катализировать различные реакции.
Одним из наиболее известных оксидов металлов, используемых в катализаторах, является оксид железа (Fe2O3). Он широко применяется в производстве аммиака, синтезе метанола и преобразовании угарного газа. Оксид железа обладает высокой активностью и способностью катализировать реакции окисления и гидрирования.
Еще одним примером оксида металла, используемого в катализаторах, является оксид цинка (ZnO). Он используется в процессе синтеза метанола, аммиака и других продуктов. Оксид цинка обладает высокой активностью и способностью катализировать реакции дехидрирования и гидрирования.
Кроме того, оксиды металлов, такие как оксид кобальта (CoO) и оксид никеля (NiO), также широко применяются в катализаторах. Они используются в процессе гидрогенирования и перекисного окисления. Оксиды кобальта и никеля обладают высокой активностью и способностью катализировать реакции окисления и восстановления.
Таким образом, использование оксидов металлов в катализаторах позволяет значительно увеличить эффективность и скорость реакций. Оксиды металлов обладают высокой активностью и способностью катализировать различные химические превращения, что делает их незаменимыми компонентами в современных промышленных процессах.
Защитные покрытия для металлических конструкций от окисления

Металлические конструкции подвержены воздействию кислорода, что приводит к их окислению и последующей коррозии. Однако, существуют различные методы защиты, позволяющие предотвратить или замедлить процесс окисления.
Одним из самых эффективных способов защиты металлических конструкций от окисления является нанесение специальных защитных покрытий. Эти покрытия создают барьер между металлом и кислородом, препятствуя проникновению влаги и воздуха, которые являются основными источниками окисления.
Для создания защитных покрытий могут использоваться различные материалы, такие как эмали, лаки и плёнки. Однако, наиболее эффективными считаются органические покрытия на основе полимеров, которые обеспечивают высокую стойкость к атмосферным воздействиям и длительный срок службы. Важно отметить, что выбор материала для покрытия зависит от конкретных условий эксплуатации металлической конструкции.
Для повышения эффективности защиты металлических конструкций от окисления может быть применено сочетание нескольких методов. Например, на первом этапе наносится слой антикоррозионного покрытия, который предотвращает проникновение кислорода и влаги до металла. Затем наносится декоративное покрытие, которое не только придает металлической конструкции эстетический вид, но и дополнительно защищает ее от атмосферных воздействий.
Вопрос-ответ

Как происходит взаимодействие металлов с кислородом?
Взаимодействие металлов с кислородом может происходить в нескольких формах, включая окисление, образование оксидов и гидроксидов. В результате этого процесса металлы могут образовать ржавчину или корку.
Какие металлы реагируют с кислородом?
Большинство металлов реагируют с кислородом. Некоторые из них, такие как железо, алюминий и магний, образуют пассивную пленку оксида, которая предотвращает дальнейшее окисление. Другие металлы, такие как никель и медь, могут продолжать окисляться при взаимодействии с кислородом.
Какие эксперименты проводятся для изучения взаимодействия металлов с кислородом?
Для изучения взаимодействия металлов с кислородом проводятся различные эксперименты. Например, могут использоваться электрохимические методы, такие как циклическая вольтамперометрия, для измерения кинетики реакции между металлом и кислородом. Также может использоваться спектроскопия для анализа образовавшихся оксидов и гидроксидов.
Какое применение имеет взаимодействие металлов с кислородом?
Взаимодействие металлов с кислородом имеет широкое применение в различных областях. Например, реакция окисления может использоваться для производства различных оксидных материалов, которые используются как катализаторы, электроды или материалы для изоляции. Кроме того, взаимодействие металлов с кислородом может применяться для защиты от коррозии и создания покрытий на поверхности металлов.
Каким образом взаимодействие металлов с кислородом может приводить к образованию ржавчины?
При взаимодействии металлов с кислородом, особенно наличии влаги, может происходить образование ржавчины. Это связано с окислением металла и образованием гидроксида или оксида металла на поверхности. Ржавчина может приводить к дальнейшему разрушению металла и ухудшению его свойств.
