Металлы - это группа химических элементов, которые характеризуются высокой электропроводностью, блестящей поверхностью и способностью образовывать ионные соединения. Активность металлов - это их способность вступать в химические реакции и образовывать соединения с другими веществами. Важным аспектом активности металлов является их положение в ряду электрохимической активности.
Все металлы могут быть разделены на активные и низкореактивные. Активные металлы обладают большей активностью и легкостью вступают в реакции с другими веществами. Они имеют положительный электродный потенциал и сильно окисляются при взаимодействии с окислителями. К низкореактивным металлам относятся золото, серебро, платина и многие другие, они обладают малой активностью и не окисляются при обычных условиях.
Правила и порядок активности металлов определяются рядом электрохимической активности. По этому ряду можно сказать, какой металл будет окисляться, а какой будет выступать в роли окислителя. Чем выше металл расположен в ряду активности, тем он более активен и тем большую реакцию окисления способен провести. Также по ряду активности можно определить, какие металлы могут быть использованы в качестве анодов и катодов в электролизе и других электрохимических процессах.
Важно отметить, что металлы справа в ряду активности, такие как щелочные и щелочноземельные металлы, обладают самой высокой активностью и сильно реагируют с водой, кислородом и другими веществами. Они используются в промышленности для производства различных металлических соединений и изделий. Металлы слева от водорода в ряду активности, такие как золото и платина, являются самыми низкореактивными металлами и используются для создания ювелирных изделий и электронных компонентов.
Определение активности металлов

Металлы - материалы, которые обладают высокой электропроводностью, пластичностью и термической проводимостью. Активность металлов определяется их склонностью к химическим реакциям, особенно с кислотами и водой.
Одним из методов определения активности металлов является реакция с кислотой. Более активные металлы способны реагировать с кислотами, высвобождая водород. Чем больше выделяется водород, тем более активным является металл. Например, натрий и калий реагируют с кислотами, образуя пузырьки водорода и соответствующие соли.
Активность металлов также можно определить по их реакции с водой. Некоторые металлы, такие как натрий и калий, реагируют с водой, образуя гидроксид и высвобождая водород. Такие металлы называют активными металлами. Другие металлы, такие как железо и алюминий, не реагируют с водой, поэтому они считаются менее активными.
Определение активности металлов также можно провести с помощью реакции с солями. Более активные металлы могут вытеснять менее активные металлы из их солей. Например, цинк может вытеснить медь из ее солей, что говорит о его большей активности.
Таблица активности металлов, также называемая электрохимической серией, предоставляет информацию о порядке активности различных металлов. В этой таблице металлы упорядочены в порядке возрастания активности, где металлы в верхней части таблицы являются более активными, а металлы в нижней части - менее активными.
Влияние внешних факторов на активность металлов

Активность металлов может быть существенно изменена под воздействием различных внешних факторов. Одним из самых важных факторов, влияющих на активность металлов, является окружающая среда. Наличие кислорода, влаги и других веществ может вызвать коррозию металла, что снижает его активность.
Температура также оказывает значительное влияние на активность металлов. Некоторые металлы становятся более активными при повышении температуры, в то время как другие металлы могут становиться менее активными или даже полностью терять свои химические свойства.
Факторы, связанные с примесью катализаторов и ингибиторов, также могут существенно влиять на активность металлов. Некоторые катализаторы могут ускорять реакцию металла с другим веществом, делая его более активным, в то время как ингибиторы могут замедлять реакцию и снижать активность металла.
Кроме того, электрическое и магнитное поле могут оказывать некоторое влияние на активность металлов. Электрическое поле может привести к ускорению химических реакций, в то время как магнитное поле может оказывать дополнительную силу на электроны в металле, что изменяет его активность.
Таким образом, активность металлов может быть значительно изменена под воздействием внешних факторов, таких как окружающая среда, температура, примеси, электрическое и магнитное поле. Понимание этих факторов является важным для контроля и оптимизации процессов с использованием металлов.
Методы определения активности металлов

Активность металлов - это способность металла превращаться в ион в растворе. Определение активности металлов является важной задачей в химии и имеет широкое применение в различных областях, таких как промышленность, медицина и экология. Существует несколько методов определения активности металлов, которые основаны на различных химических реакциях и физических свойствах металлов.
Один из наиболее известных методов определения активности металлов - это измерение электродного потенциала металла. Электродный потенциал - это потенциал электрической ячейки, состоящей из металлического электрода и раствора ионов металла. Этот метод основан на том, что у каждого металла есть свой уникальный электродный потенциал, который можно измерить и использовать для определения его активности.
Другой метод определения активности металлов - это гравиметрический метод. Гравиметрия - это метод анализа, основанный на измерении массы вещества. В случае определения активности металлов с помощью гравиметрического метода, металл превращается в осадок или растворяется реактивом, а затем масса осадка или растворенного металла измеряется. Измеренная масса используется для определения активности металла.
Также существует метод определения активности металлов на основе их химической реактивности. В этом случае металл реагирует с определенным реактивом, и продукты реакции анализируются для определения активности металла. Например, активность алюминия может быть определена путем его реакции с кислородом, при которой образуется окись алюминия.
Таким образом, методы определения активности металлов многообразны и зависят от химических и физических свойств металлов. Они позволяют установить, насколько металл активен и способен взаимодействовать с другими веществами, что является важной информацией для многих областей применения металлов.
Химические реакции металлов
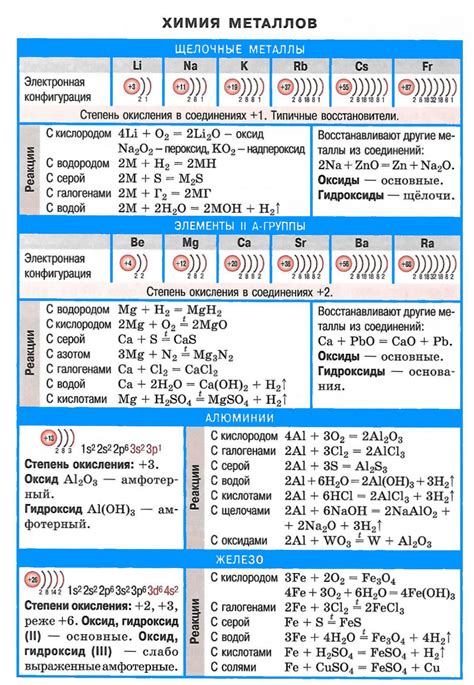
Химические реакции металлов определяются их активностью. Активность металлов в зависимости от того, как они взаимодействуют с кислородом, водородом и кислотами, может быть разной.
Металлы, которые активно реагируют с кислородом, называют активными металлами. Они способны образовывать оксиды при взаимодействии с кислородом из воздуха. Примерами активных металлов являются натрий, калий, цезий, литий и другие.
Пассивные металлы практически не реагируют с кислородом и образуют плотную пассивную пленку на поверхности. Эта пленка защищает металл от коррозии и разрушения. Примерами пассивных металлов являются алюминий, хром, нержавеющая сталь и др.
Взаимодействие металлов с водородом также может быть различным. Некоторые металлы (например, натрий, калий) реагируют с водородом с образованием гидридов. Другие металлы (например, алюминий, кальций) не взаимодействуют с водородом при обычных условиях.
Взаимодействие металлов с кислотами может протекать с образованием солей и выделением водорода. Некоторые металлы, такие как натрий и калий, реагируют с кислотой более активно и быстро, чем другие металлы, например, алюминий или цинк.
Химические реакции металлов играют важную роль в промышленности, научных исследованиях и повседневной жизни. Знание и понимание этих реакций позволяет управлять процессами, связанными с металлами, и применять их в различных областях деятельности.
Влияние активности металлов на промышленные процессы

Активность металлов играет важную роль в промышленных процессах, влияя на эффективность и результативность различных технологических операций. Высокоактивные металлы, такие как алюминий и магний, широко применяются в авиационной и автомобильной промышленности благодаря их легкости и прочности. Они позволяют снизить вес конструкций и увеличить энергоэффективность транспортных средств.
С другой стороны, низкоактивные металлы, например, железо и сталь, успешно используются в производстве строительных материалов, машин и оборудования. Они обладают высокой прочностью и устойчивостью к механическим нагрузкам, что делает их незаменимыми компонентами конструкций, подверженных высоким нагрузкам и износу.
Среди металлов особое место занимают переходные металлы, такие как железо, никель, медь и цинк. Они обладают высокой химической активностью и широко используются в химической и электротехнической промышленности. Например, медь часто используется в производстве электрических проводов и кабелей, благодаря своей хорошей электропроводности.
Помимо того, металлы могут влиять на окружающую среду в промышленных процессах. Некоторые металлы, такие как ртуть и свинец, являются токсичными и могут наносить вред здоровью человека и экосистемам при неправильном использовании. Поэтому важно контролировать и минимизировать выбросы этих металлов в окружающую среду, применяя соответствующие технологии и меры безопасности.
В целом, активность металлов имеет большое значение для промышленных процессов, определяя их эффективность, надежность и экологическую безопасность. Правильный выбор металлов и разработка соответствующих технологий позволяют достичь высокой производительности и конкурентоспособности в современной промышленности.
Взаимодействие металлов с окружающей средой

Металлы - это элементы, которые обладают определенными свойствами, такими как хорошая проводимость электричества и тепла, механическая прочность и т. д. Однако, при контакте с окружающей средой металлы подвергаются процессам взаимодействия, которые могут привести к их изменениям и разрушению.
Одной из основных причин, приводящих к взаимодействию металлов с окружающей средой, является коррозия. Коррозия - это процесс окисления металла, который происходит под воздействием кислорода и влаги. В результате коррозии образуются оксиды и гидроксиды металла, которые защищают его поверхность от дальнейшего окисления. Однако, в некоторых случаях, коррозия может привести к разрушению металла и потере его свойств.
Кроме того, металлы могут взаимодействовать с различными веществами, содержащимися в окружающей среде. Например, некоторые металлы могут реагировать с кислотами, щелочами или солями. Такие процессы могут привести к образованию новых веществ или изменению свойств металла.
Взаимодействие металлов с окружающей средой может приводить к различным последствиям. Например, в промышленности часто используется защитное покрытие для металлических изделий, чтобы предотвратить их коррозию. Также, взаимодействие металлов с окружающей средой может быть использовано для получения новых веществ или проведения различных химических реакций.
| Металл | Окружающая среда | Результат взаимодействия |
|---|---|---|
| Железо | Влага и кислород | Коррозия и образование ржавчины |
| Алюминий | Кислород и щелочи | Образование оксида алюминия и гидроксида алюминия |
Таким образом, взаимодействие металлов с окружающей средой является неизбежным процессом, который может приводить к изменению свойств металла и его разрушению. Понимание этих процессов позволяет разработать методы защиты металлов от воздействия окружающей среды и использовать их в различных химических реакциях.
Вопрос-ответ

Какие металлы считаются активными?
Активными считаются металлы, которые способны с легкостью реагировать с другими веществами и образовывать соединения. Например, натрий, калий, цезий, магний, цинк и многие другие металлы.
Каковы основные правила реакции активных металлов с кислотами?
При реакции активных металлов с кислотами, образуется соль и выделяется водород. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода.
Почему активные металлы реагируют с водой?
Активные металлы реагируют с водой, потому что они способны отдавать электроны и образовывать ионы металла и гидроксида. Например, реакция натрия с водой приводит к образованию натриевого гидроксида и выделению водорода.
