Ряд активности металлов – это сравнительная характеристика разных металлов по их способности вступать в химические реакции с кислородом. Знание ряда активности металлов является важной составляющей химического образования учеников 8 класса.
Понимание ряда активности металлов позволяет предсказывать, какой металл реагирует с кислородом наиболее интенсивно, образуя окисленные соединения. Это знание может быть применено для объяснения поведения металлов в различных химических процессах, таких как окисление, восстановление и растворение.
Практические задания по изучению ряда активности металлов помогут ученикам продолжить самостоятельное исследование и закрепить полученные знания. Они смогут провести эксперименты, в которых будут определять активность различных металлов, рассматривать их взаимодействие с различными веществами и изучать свойства образованных соединений.
Знание ряда активности металлов является важным инструментом для понимания мировой химической реактивности. Закрепите полученные знания практическими заданиями и ощутите себя настоящими химиками, проводя эксперименты и анализируя результаты!
Понятие ряда активности металлов

Ряд активности металлов — это упорядоченный список металлов в порядке их химической активности. В этом ряду металлы располагаются от самого активного до самого инертного. Чем выше металл в ряду, тем больше его активность.
Ряд активности металлов позволяет сравнивать металлы между собой по их способности вступать в химические реакции. На основе этого ряда можно предсказать, будет ли металл вступать в реакцию с кислотами, водой или другими веществами.
На верхнем конце ряда активности находятся металлы, которые легко реагируют с кислородом, водой и кислотами. Эти металлы называются активными. Они обладают сильным окислительным действием и могут активно взаимодействовать с другими веществами.
На нижнем конце ряда активности находятся металлы, которые практически не реагируют с кислородом, водой и кислотами. Эти металлы называются инертными. Они обладают слабым окислительным действием и предпочитают находиться в стабильном состоянии.
Раздел 1

Активность металлов – это способность металла реагировать с веществами окружающей среды и проявлять химическую активность. Эта характеристика имеет большое значение в различных областях науки и техники.
В зависимости от своей активности металлы делятся на активные и пассивные. Активные металлы, такие как натрий, калий, магний и другие, активно реагируют с кислородом, водой и кислотами. Они способны вытеснять металлы из их соединений и образовывать с ними новые вещества.
Пассивные металлы, такие как золото, платина и серебро, обладают низкой химической активностью. Они практически не взаимодействуют с кислородом и водой, их поверхность не подвергается окислению и коррозии.
Изучение активности металлов имеет важное практическое значение. К примеру, зная активность металла, можно предсказать его способность к окислению и коррозии. Это позволяет разрабатывать специальные покрытия и защитные пленки, предотвращающие порчу металлических изделий. Также знание активности металлов используется при выборе материалов для производства различных компонентов и изделий в разных отраслях промышленности.
Измерение электродного потенциала металлов
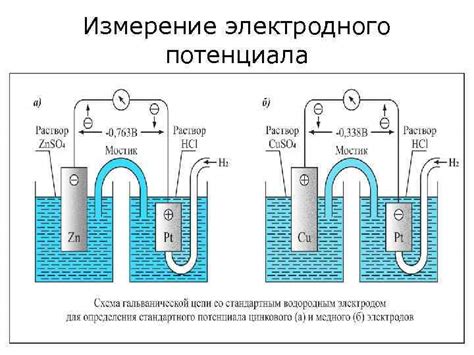
Электродный потенциал металлов является важной характеристикой, определяющей их способность участвовать в электрохимических реакциях. Измерение электродного потенциала металлов позволяет определить их способность к окислительной или восстановительной реакции.
Для измерения электродного потенциала металлов используется электрохимическая ячейка, состоящая из двух электродов – исследуемого металла и эталонного электрода. Исследуемый металл подключается к положительному выводу вольтметра, а эталонный электрод – к отрицательному. Затем производится сравнение напряжения, возникающего между эталонным и исследуемым электродами, с известными потенциалами эталонных электродов.
Измерение электродного потенциала металлов может проводиться в различных условиях – при разных температурах, в разных электролитах и с различным составом электролитов. При этом важно учитывать влияние концентрации электролита на потенциал металла. Также, для получения более точных результатов, измерение следует проводить несколько раз и усреднить полученные значения.
Результаты измерения электродного потенциала металлов могут применяться в различных областях. Например, в химии они могут использоваться для определения химической активности металлов или выбора оптимального металла для проведения определенной реакции. В электротехнике эти данные могут помочь в выборе подходящего материала для проводов или электродов. В экологии измерение электродного потенциала металлов может быть полезным при определении их токсичности или степени окисления в окружающей среде.
Раздел 2

Практические задания для учеников 8 класса по ряду активности металлов
Задание 1:
Используя информацию о ряде активности металлов, составьте таблицу, отражающую их активность от наиболее активного до наименее активного. Для каждого металла укажите его название и покажите его положение в ряду активности.
Задание 2:
Выберите два металла из списка и проведите эксперимент, чтобы проверить их активность. Запишите результаты эксперимента и сделайте вывод о том, какой из металлов более активный.
Задание 3:
Проведите исследование, чтобы определить, как действие разных кислот влияет на активность металлов. Запишите результаты и сделайте выводы о том, какие кислоты усиливают активность металлов, а какие ее ослабляют.
Задание 4:
Составьте уравнения реакций между различными металлами и кислотами. Укажите, какие металлы реагируют с какими кислотами и образующиеся при этом вещества.
Задание 5:
Исследуйте реакцию между металлами и водой. Определите, какие металлы реагируют с водой, образуя газ, и запишите эти реакции в виде уравнений.
Итак, приступая к выполнению практических заданий по ряду активности металлов, ученики 8 класса получат возможность не только закрепить теоретические знания, но и сделать интересные открытия с помощью экспериментов.
Практические задания по определению активности металлов

Определение активности металлов является важным практическим заданием, позволяющим ученикам узнать, какой металл обладает большей активностью в ряду. Это помогает предсказывать, какие металлы смогут замещать друг друга в реакциях.
Для проведения данного эксперимента потребуется ряд образцов различных металлов, например, цинка, железа, магния и меди. Ученики могут также использовать различные соединения металлов, например, сульфат цинка, сульфат железа и др. Необходимо предоставить ученикам различные инструменты и реактивы для проведения эксперимента.
Шаги определения активности металлов могут быть следующими:
- Подготовить различные растворы металлов или образцы металлов.
- Наблюдать реакцию каждого металла с раствором другого металла. Например, можно поместить образец цинка в раствор сульфата меди и наблюдать, что происходит.
- Фиксировать результаты реакций и сравнивать их. Например, если образец цинка активнее, то будет видно проявление реакции, а если меди - то не будет.
- Составить ряд активности металлов, основываясь на результате опытов. Важно помнить, что металлы в ряду упорядочиваются по убыванию активности.
Это интересное и доступное практическое задание позволяет ученикам не только закрепить знания о химических свойствах металлов, но и развить навыки наблюдения, сравнения и анализа результатов. Кроме того, определение активности металлов имеет важное практическое применение в различных отраслях науки и промышленности.
Раздел 3

Определение активности металлов
Раздел 3 посвящен определению активности металлов. Активность металла определяется способностью элемента вступать в химические реакции с другими веществами и вытеснять более слабые металлы из их соединений. Определение активности металлов осуществляется с помощью ряда активности. Ряд активности представляет собой список металлов, расположенных в порядке убывания их активности.
Применение ряда активности
Ряд активности металлов является важным инструментом в химии и находит широкое применение в различных областях. Он позволяет определить, какой металл сможет вытеснить другой из его соединения, а также указывает, какие реакции будут происходить между металлами и кислотами. Ряд активности также может использоваться для выбора материала, который не будет коррозировать в определенных условиях.
В химии ряд активности металлов облегчает проведение лабораторных экспериментов и позволяет предсказать результаты реакций. Он помогает ученым выявить закономерности в химических реакциях и разработать эффективные методы получения и очистки металлов. Кроме того, ряд активности служит основой для изучения электрохимии и анализа редких металлов.
Таблица ряда активности
Для удобства использования ряд активности металлов представляется в виде таблицы. В таблице указаны названия металлов, их химические символы и положение в ряду активности. Чем выше металл расположен в ряду, тем активнее он является. Элементы в таблице располагаются по возрастанию их электрохимического потенциала.
| Металл | Химический символ |
|---|---|
| Литий | Li |
| Калий | K |
| Барий | Ba |
| Ртуть | Hg |
Такая таблица позволяет быстро определить активность металла и его возможности в химических реакциях. В примере выше видно, что литий является самым активным металлом, а ртуть - наименее активным.
Примеры химических реакций металлов в ряду активности

Железо, находящееся в ряду активности металлов, обладает способностью реагировать с кислородом воздуха, образуя ржавчину. При этой реакции образуется оксид железа, которая при дальнейшем взаимодействии с влагой может переходить в гидроксид железа. Также железо может реагировать с соляной кислотой, образуя хлорид железа и выделяя водород.
Алюминий имеет высокую активность и реагирует с кислотами, освобождая водород. Например, при реакции с соляной кислотой образуется хлорид алюминия и водород. Кроме того, алюминий может вступать в реакцию с кислородом, при этом образуется оксид алюминия.
Цинк также проявляет активность при реакции с кислотами. При взаимодействии с серной кислотой образуется сульфат цинка и выделяется водород. Оксид цинка образуется при реакции металла с кислородом воздуха. Кроме того, цинк может реагировать с раствором щелочи, образуя гидроксид цинка и выделяя аммиак.
Медь проявляет низкую активность по сравнению с другими металлами в ряду. Она не реагирует с обычными кислотами, но может взаимодействовать с раствором разбавленной серной кислоты. При этой реакции образуется сульфат меди и выделяется диоксид серы. Также медь может реагировать с концентрированными растворами щелочей, образуя гидроксид меди и выделяя аммиак.
Свинец находится в ряду металлов с низкой активностью и почти не реагирует с обычными кислотами. Однако он может растворяться в концентрированной соляной кислоте или кислоте ацетонитриловой, образуя плавиковую кислоту. Свинец также может реагировать с некоторыми сильными окислителями, образуя соответствующие соли.
Вопрос-ответ

Какой порядок активности металлов можно объяснить на основе реакций с кислотами?
Порядок активности металлов можно объяснить на основе их реакций с кислотами. Большинство металлов реагируют с кислотами, образуя соли и выделяя водород. Однако активность металлов различна. Наиболее активные металлы (например, натрий, калий) reaмяействуют даже с разбавленными кислотами, образуя соли и выделяя водород. Менее активные металлы (такие как железо, цинк, свинец) реагируют только с концентрированными кислотами. А самые неподвижные металлы, такие как серебро и золото, практически не реагируют с кислотами. Поэтому порядок активности металлов можно установить исходя из их способности реагировать с кислотами.
