Электрохимическая коррозия является одним из наиболее распространенных и серьезных процессов разрушения металлов. В результате коррозии происходит разрушение структуры материала и снижение его прочности, что может привести к серьезным последствиям, включая потерю стабильности и безопасности конструкций.
В процессе электрохимической коррозии важную роль играют два основных элемента - анод и катод. Анод - это область поверхности металла, где происходит окисление и потеря электронов. Катод - это область поверхности, где происходит восстановление и электронный перенос. Процесс электрохимической коррозии возникает при наличии электролитической среды, которая служит проводником для электрических токов и участвует в химических реакциях.
Роль анода в процессе электрохимической коррозии заключается в том, что он является областью металла, где происходит окисление и осуществляется потеря электронов. Именно здесь начинается разложение материала, образуются коррозионные продукты и происходит ухудшение структуры металла. В процессе окисления электроны переносятся с анода на катод, создавая разность потенциалов и вызывая характерные электрохимические реакции.
Распределение анода и катода в процессе электрохимической коррозии зависит от множества факторов, включая физические и химические свойства материалов, окружающую среду, условия эксплуатации и многое другое. Правильное понимание роли анода в процессе коррозии является ключевым для разработки эффективных методов предотвращения и защиты от электрохимической коррозии металлов.
Механизм электрохимической коррозии металла
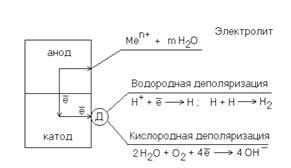
Электрохимическая коррозия металла является процессом разрушения материала под воздействием окружающей среды и в результате электрохимических реакций. Один из ключевых элементов этого процесса - механизм, по которому металл подвергается коррозии.
Механизм электрохимической коррозии металла связан с присутствием ионов в растворе, в котором находится металл. Вода или другой электролит контактирует с поверхностью металла и создает ионные связи. Когда металл находится в контакте с этим электролитом, между его поверхностью и раствором образуются различные элементарные электрокимические ячейки.
В этих ячейках металл действует как катод и анод одновременно. В процессе коррозии металла вокруг анода образуются окислительные реакции, которые приводят к растворению атомов металла и образованию металлических ионов. С другой стороны, вокруг катода происходят восстановительные реакции, где ионы реагируют с водой или другими веществами, что приводит к образованию водорода или других продуктов.
Таким образом, в процессе электрохимической коррозии металла анод выполняет роль места, где происходит окисление металла и образование ионов, которые перемещаются через электролит. Катод, в свою очередь, является местом, где осуществляется восстановление ионов, что позволяет сохранять заряд ячейки и продолжать процесс коррозии.
Роль анода в электрохимической коррозии
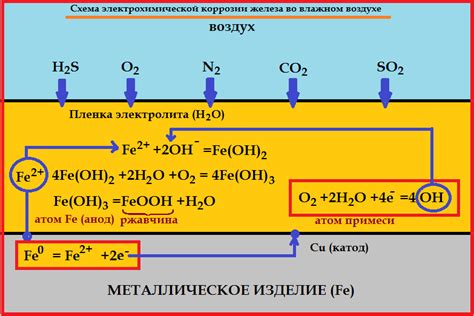
Электрохимическая коррозия металла - это процесс разрушения металлической поверхности под действием химических реакций, происходящих в присутствии воды, воздуха и прочих активных веществ. Один из ключевых элементов этого процесса - анод, который играет важную роль в реакции коррозии.
Анод представляет собой область на поверхности металла, которая окисляется и теряет электроны в процессе электрохимической реакции. Это место, где происходит активное проявление коррозии. Металлические ионы, образующиеся в результате окисления анода, затем движутся к катоду.
Катод, в свою очередь, принимает электроны, которые были потеряны анодом. Он является областью металлической поверхности, которая участвует в редокс-реакции, при которой происходит уменьшение окислителя. Катод представляет собой место, где металлические ионы восстанавливаются, образуя нежелательные осадки или соединения.
Важно отметить, что анод играет роль принимающего окисленные электроны элемента, который теряет электроны. Он также является местом, где начинается химическая реакция, приводящая к образованию оксидов и ионов, которые затем приводят к дальнейшему разрушению металлической поверхности.
Для защиты от электрохимической коррозии часто используются различные методы, включающие жертвенные аноды, катодную защиту или покрытие металла защитными покрытиями. Но без понимания роли анода в электрохимической коррозии невозможно разработать эффективные методы предотвращения коррозии и защиты металлических конструкций.
Электрохимические процессы, протекающие на аноде
Анод в электрохимической коррозии металла играет особую роль. При этом происходят различные процессы, которые могут быть крайне вредными для металлического материала.
Один из главных процессов, протекающих на аноде – это анодное растворение или окисление металла. Во время этого процесса, на поверхности анода образуется окисная пленка, которая содержит ионы металла и электроны. Эта пленка может быть тонкой и неуловимой, но она препятствует дальнейшей коррозии, так как ее сопротивление электрическому току высоко. Однако, если окисная пленка повреждается или становится менее стабильной, возможно продолжение коррозионных процессов.
На аноде также может протекать процесс выделения газов. При коррозии металла, газы могут образовываться в результате реакций, происходящих на поверхности анода. Выделение газов может приводить к образованию пузырьков, которые со временем могут разрушать окисные пленки и способствовать ускоренной коррозии металла.
Также, на аноде могут протекать процессы диссоциации и реакции окисления. Диссоциация – это процесс, при котором ионы металла распадаются на положительные и отрицательные заряды. Реакции окисления связаны с передачей электронов от металла на другие вещества, что приводит к коррозии металла и образованию окисей.
Таким образом, на аноде при электрохимической коррозии металла происходит анодное растворение, выделение газов, диссоциация и реакции окисления. Понимание и контроль этих процессов являются важными в области борьбы с коррозией и защиты металлических конструкций.
Влияние окружающей среды на анодную коррозию металла
Анодная коррозия металла представляет собой процесс, при котором металлический предмет выступает в роли анода, теряя свою массу и разрушаясь под воздействием окружающей среды. Этот процесс может протекать в различных условиях и зависит от типа окружающей среды.
Окружающая среда играет важную роль в анодной коррозии металла. Она определяет химическую активность веществ, которые могут образовываться на поверхности металла и ускорять анодную коррозию. Воздействие кислотных или щелочных сред может привести к образованию коррозионных продуктов, которые разрушают поверхность металла.
При анодной коррозии металла важно учитывать также наличие растворенных веществ в окружающей среде. Это могут быть соли или другие химические соединения, которые могут оказывать дополнительное влияние на анодный процесс. Их наличие может ускорять анодную коррозию и способствовать разрушению металлической поверхности.
Температура окружающей среды также оказывает влияние на анодную коррозию металла. Высокая температура может ускорить процесс разрушения металла, поскольку повышает активность химических реакций на поверхности металла. В свою очередь, низкая температура может замедлить рост коррозионных продуктов и замедлить процесс анодной коррозии.
Итак, окружающая среда играет ключевую роль в анодной коррозии металла. Химические вещества, растворенные в окружающей среде, а также температурные условия могут значительно влиять на процесс анодной коррозии и приводить к разрушению металлической поверхности.
Методы защиты от анодной коррозии

Анодная коррозия является одной из самых неприятных проблем в области электрохимической коррозии металлов. Она возникает в результате разности потенциалов на поверхности металла, когда его часть начинает выступать в роли анода и подвергаться активному разрушению.
Для предотвращения анодной коррозии используются различные методы защиты. Один из самых популярных методов - использование анодной защиты при помощи катодных защитных систем. При этом на поверхность металла наносятся катодные защитные материалы, которые обладают более высоким потенциалом, чем сам металл. Таким образом, они принимают на себя роль анода и защищают металл от коррозии.
Еще одним методом защиты от анодной коррозии является использование специальных антикоррозионных покрытий. Они создают защитный слой на поверхности металла, который предотвращает контакт металла с агрессивными средами, вызывающими коррозию. Такие покрытия могут быть обеспечены, например, за счет применения специальных красок или пленок.
Дополнительно, для защиты от анодной коррозии могут быть использованы специальные добавки к среде или жидкости, в которой находится металл. Такие добавки могут нейтрализовать агрессивные вещества и предотвращать разрушение металла в результате анодной коррозии.
Важно отметить, что выбор метода защиты от анодной коррозии зависит от конкретной ситуации и условий эксплуатации. В некоторых случаях может потребоваться комбинация нескольких методов или применение специальных технологий. Поэтому, перед выбором метода защиты необходимо провести детальную оценку состояния металла и анализ возможных рисков коррозии.
Примеры практического применения учета анодной коррозии

Учет анодной коррозии является важным аспектом в различных промышленных сферах, где используются металлические конструкции и оборудование, подверженные воздействию коррозивных сред. Вот несколько примеров практического применения учета анодной коррозии.
1. Нефтегазовая отрасль: В нефтегазовой отрасли множество трубопроводов, резервуаров и других металлических конструкций подвержены коррозии, особенно в среде с высоким содержанием солей и кислот. Учет анодной коррозии позволяет определить потенциально опасные зоны и разработать соответствующие меры для защиты от коррозии, такие как использование антикоррозионных покрытий или систем катодной защиты.
2. Автомобильная промышленность: В автомобильной промышленности анодная коррозия является распространенной проблемой, особенно для деталей и компонентов, которые подвержены постоянному воздействию влаги и солевых растворов на дорогах зимой. Учет анодной коррозии помогает определить уязвимые зоны и разработать более прочные и коррозионно-стойкие материалы.
3. Морская промышленность: В морской промышленности, которая сильно зависит от металлических конструкций и оборудования, анодная коррозия является особенно проблематичной из-за постоянного воздействия соленой воды. Учет анодной коррозии используется для определения областей с высоким риском коррозии и разработки методов защиты, таких как антикоррозионные покрытия, системы катодной защиты и регулярное обслуживание.
4. Энергетическая промышленность: В энергетической промышленности учет анодной коррозии используется для оценки состояния металлических трубопроводов, использования которых связано с постоянным контактом с агрессивными средами, такими как нефть, газ и вода. Это позволяет предотвратить возможные аварии и повысить безопасность работы энергетических установок.
Таким образом, учет анодной коррозии имеет широкое практическое применение в различных отраслях, где металлические конструкции подвержены воздействию коррозии. Это позволяет предотвратить повреждение и деградацию оборудования, обеспечить безопасность и продлить срок службы конструкций.
Вопрос-ответ

Какая роль выполняется анодом при электрохимической коррозии металла?
Анод выполняет роль положительно заряженного электрода, который теряет электроны и обеспечивает окисление металла.
Почему анод является основным источником коррозионных процессов?
Анод является основным источником коррозионных процессов, так как он окисляется и теряет электроны, что приводит к образованию ионов металла, которые затем реагируют с окружающей средой и вызывают коррозию.
Что происходит на аноде при электрохимической коррозии металла?
На аноде происходит окисление металла, т.е. передача электронов с поверхности металла на растворенные ионы. Это позволяет аноду служить источником электронов для реакции коррозии.
