Уравнения реакции с металлами представляют собой особый вид химических уравнений, которые описывают процесс реакции между металлом и другим веществом. Решение таких уравнений является важным этапом химического анализа и позволяет получить информацию о реактивности металла, его окислительно-восстановительных свойствах, а также предсказать направление реакции и вид получающихся продуктов.
Для решения уравнений реакции с металлами необходимо следовать определенному алгоритму действий. В первую очередь необходимо определить тип реакции: может быть это окислительно-восстановительная реакция, реакция с образованием соли или реакция с выделением водорода. Затем следует записать уравнение реакции, учитывая сохранение массы и заряда в системе. Для этого необходимо уравнять число атомов каждого элемента с обеих сторон реакционного уравнения.
Решение уравнения реакции с металлом может потребовать знания химических свойств металла, его окислительной способности и взаимодействия с различными веществами. Часто применяются методы балансировки уравнений, такие как метод полубаланса, метод последовательного приписывания или метод ионно-электронного баланса. В результате правильного решения уравнения можно получить полные химические формулы реагентов и продуктов реакции с металлов, что позволяет проводить дополнительные расчеты или анализировать химический процесс.
Вводные данные для решения
Уравнения реакции с металлами - это химические реакции, в которых металл взаимодействует с другим веществом и превращается в ион или соединение. Для успешного решения уравнения реакции с металлом необходимо иметь некоторые вводные данные.
Во-первых, нужно знать химический символ металла, с которым происходит реакция. Например, для алюминия химический символ - Al, для железа - Fe, для меди - Cu.
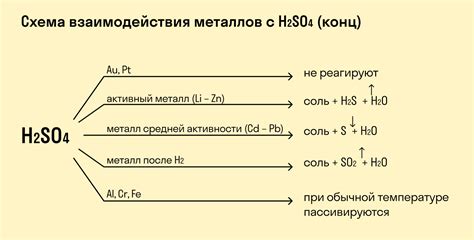
Во-вторых, нужно знать химическую формулу вещества, с которым металл взаимодействует. Это может быть оксид, соль или кислота. Например, для оксида кислорода химическая формула - O, для хлорида натрия - NaCl, для серной кислоты - H2SO4.
Также полезно знать окислительное число металла. Окислительное число - это число, которое показывает, сколько электронов металл отдал или принял во время реакции. Значение окислительного числа металла может быть положительным или отрицательным.
Собрав все необходимые вводные данные, можно перейти к решению уравнения реакции с металлом. Процесс решения включает в себя балансировку уравнения, определение ионов или соединений, образующихся в результате реакции, и запись окончательного уравнения с правильными коэффициентами перед каждым веществом.
Шаги решения уравнений реакции с металлами
Решение уравнений реакции с металлами требует выполнения определенных шагов. Начнем с определения входящих в реакцию веществ и их окислительного состояния.
Первый шаг заключается в записи химической формулы металла и его окислительного состояния перед реакцией, а также химической формулы вещества или иона, вступающего в реакцию с металлом.
Далее нужно определить вещества, образующиеся в результате реакции, и их окислительное состояние после реакции. Это позволит записать химическую формулу конечного продукта реакции.
На следующем шаге следует уравнять количество атомов каждого элемента в обоих частях уравнения реакции. Для этого можно использовать коэффициенты перед формулами веществ.
После уравнивания уравнения необходимо проверить, что сумма зарядов на обоих сторонах уравнения совпадает. Если суммы зарядов не совпадают, следует ввести соответствующие ионы, чтобы соблюсти правило сохранения заряда.
В конце рекомендуется проверить уравнение реакции с помощью метода проверки по массе, чтобы убедиться в правильности решения.
Примеры решения уравнений реакции с металлами
Пример 1:
Рассмотрим уравнение реакции между железом и кислородом. Железо может иметь несколько степеней окисления, но в данном случае примем его как Fe(0). Кислород имеет степень окисления -2. Уравнение реакции между железом и кислородом будет выглядеть как:
2 Fe + O2 → 2 FeO
Таким образом, при окислении железа кислородом образуется оксид железа(II) (FeO).
Пример 2:
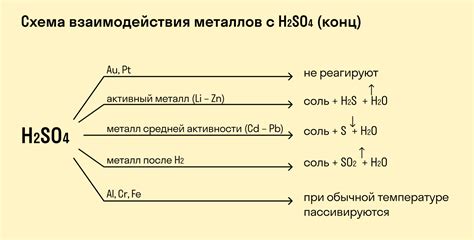
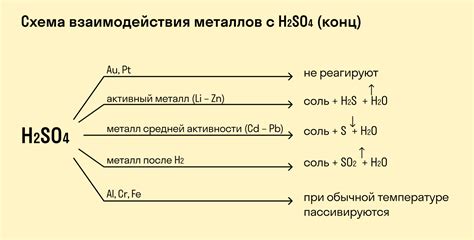
Рассмотрим уравнение реакции между цинком и серной кислотой. Цинк имеет степень окисления 0, а серная кислота имеет степень окисления +6. Уравнение реакции будет выглядеть как:
Zn + H2SO4 → ZnSO4 + H2
Таким образом, при реакции цинка с серной кислотой образуется сульфат цинка (ZnSO4) и выделяется молекулярный водород (H2).
Пример 3:
Рассмотрим уравнение реакции между алюминием и серной кислотой. Алюминий имеет степень окисления 0, а серная кислота имеет степень окисления +6. Уравнение реакции будет выглядеть как:
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2
Таким образом, при реакции алюминия с серной кислотой образуется сульфат алюминия (Al2(SO4)3) и выделяется молекулярный водород (H2).
- Использовалось несколько примеров реакций между различными металлами и кислотами;
- Указаны степени окисления для каждого вещества;
- Уравнение реакции выражено в химических формулах с использованием соответствующих коэффициентов;
- Образованные в результате реакции вещества указаны с использованием их химических формул.
Полезные советы при решении уравнений реакции с металлами
Решение уравнений реакции с металлами может быть сложной задачей, но с помощью нескольких полезных советов вы сможете легко выполнять такие расчеты.
1. Знание химических свойств металлов
Перед тем, как приступить к решению уравнения реакции с металлами, необходимо хорошо знать химические свойства конкретного металла. Важно знать его электрохимический ряд, способность к окислению и восстановлению, а также его степень окисления в различных соединениях.
2. Обратить внимание на срок действия уравнения
При решении уравнений реакции с металлами, необходимо учитывать, что реакция может протекать только до тех пор, пока все реагенты не будут полностью использованы или пока определенное количество продукта не будет образовано. Не забывайте указывать эти условия в своих расчетах.
3. Уравновешивание уравнения
Важным шагом при решении уравнений реакции с металлами является уравновешивание, чтобы число атомов каждого элемента на левой и правой сторонах уравнения было одинаковым. Используйте метод коэффициентов перед формулами соединений, чтобы достичь этого баланса.
4. Ведение таблицы реакций
Для более удобного учета и проведения расчетов, полезно вести таблицу реакций, в которой вы будете отмечать все входящие реагенты и образующиеся продукты, а также их степень окисления и коэффициенты. Такой подход позволит вам более наглядно видеть ход реакции и легче управлять ее процессом.
5. Практика и проверка
Чем больше вы будете решать уравнения реакции с металлами, тем лучше становится ваш навык. Регулярная практика позволит вам быстрее и точнее выполнять такие расчеты. Также не забывайте проверять свои результаты при помощи химических таблиц и других источников, чтобы убедиться в правильности своих ответов.
Важно помнить, что решение уравнений реакции с металлами требует не только знания химических свойств металлов, но и внимательности и точности при проведении расчетов. Следуя этим полезным советам, вы сможете достичь успеха в решении таких задач.
Вопрос-ответ

Какие способы существуют для решения уравнений реакции с металлами?
Существует несколько способов, включая способ наделения и способ окисления-восстановления.
Что такое способ наделения? Как он применяется для решения уравнений реакции с металлами?
Способ наделения основан на использовании реакции между металлом и кислотой. Металл образует соль, а водород выделяется в виде газа.
Каким образом применяется способ окисления-восстановления для решения уравнений реакции с металлами?
Способ окисления-восстановления используется, когда металл вступает в реакцию с окислителем или восстановителем. Уравнение реакции балансируется путем изменения коэффициентов перед веществами в уравнении.
Можешь привести пример решения уравнения реакции с металлом с помощью способа наделения?
Конечно! Рассмотрим реакцию между цинком и серной кислотой. Цинк имеет степень окисления 0, а серная кислота имеет степень окисления +6. При взаимодействии цинка и серной кислоты происходит реакция, в результате которой образуется соль цинка и выделяется водород. Уравнение реакции: Zn + H2SO4 → ZnSO4 + H2. Уравнение балансируется путем изменения коэффициентов перед веществами: Zn + H2SO4 → ZnSO4 + 2H2.
Какой способ решения уравнений реакции с металлами эффективнее?
Оба способа имеют свои преимущества и могут быть эффективными в зависимости от конкретной реакции. Выбор способа зависит от реакционных условий и химических свойств веществ. Некоторые реакции легче решить с помощью способа наделения, а другие - с помощью способа окисления-восстановления.
